Rané představy o hmotě: Od Demokrita k Daltonovi
Moderní atomová teorie

Priestley, Lavoisier a další položili základy oboru chemie. Jejich pokusy ukázaly, že některé látky se mohou spojovat s jinými a vytvářet nové materiály, jiné látky lze rozložit na jednodušší a několik klíčových „prvků“ nelze dále rozložit. Čím však vysvětlit tento složitý soubor pozorování? John Dalton, výjimečný britský učitel a vědec, dal dohromady jednotlivé části a v roce 1803 vytvořil první moderní atomovou teorii. Chcete-li se dozvědět více o Priestleyho a Lavoisierových experimentech a o tom, jak se staly základem Daltonovy teorie, vyzkoušejte interaktivní experiment Daltonova hříčka, na který odkazujeme níže.
Dalton měl ve zvyku pravidelně sledovat a zaznamenávat počasí ve svém rodném městě Manchesteru v Anglii. Díky pozorování ranních mlh a dalších povětrnostních jevů si Dalton uvědomil, že voda může existovat jako plyn, který se mísí se vzduchem a zaujímá stejný prostor jako vzduch. Pevné látky nemohly zaujímat stejný prostor jako ostatní, například led se nemohl mísit se vzduchem. Co tedy mohlo vodě umožnit, aby se někdy chovala jako pevná látka a někdy jako plyn? Dalton si uvědomil, že veškerá hmota se musí skládat z malých částic. V plynném stavu se tyto částice volně vznášely a mohly se mísit s jinými plyny, jak navrhoval Bernoulli. Dalton však tuto myšlenku rozšířil na všechny látky – plyny, pevné látky i kapaliny. Dalton poprvé navrhl část své atomové teorie v roce 1803 a později tyto koncepty zdokonalil ve svém klasickém článku A New System of Chemical Philosophy z roku 1808 (ke kterému se můžete dostat prostřednictvím odkazu v záložce Zdroje).
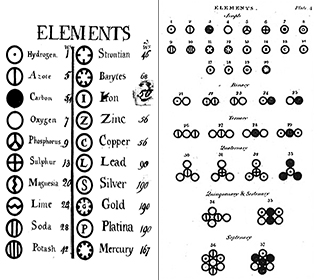
Daltonova teorie měla čtyři hlavní koncepce:
-
Všechna hmota se skládá z nedělitelných částic zvaných atomy. Bernoulli, Dalton a další si představovali atomy jako malé částice podobné kulečníkové kouli v různých pohybových stavech. Toto pojetí je sice užitečné pro pochopení atomů, ale není správné, jak uvidíme v pozdějších modulech o atomové teorii, na které odkazujeme v dolní části tohoto modulu.
-
Všechny atomy daného prvku jsou identické; atomy různých prvků mají různé vlastnosti. Daltonova teorie předpokládala, že každý jednotlivý atom prvku, například kyslíku, je totožný s každým jiným atomem kyslíku; navíc atomy různých prvků, například kyslíku a rtuti, se od sebe liší. Dalton charakterizoval prvky podle jejich atomové hmotnosti; když však byly koncem 19. století objeveny izotopy prvků, tato koncepce se změnila.
-
Chemické reakce zahrnují slučování atomů, nikoliv jejich ničení. Atomy jsou nezničitelné a neměnné, takže sloučeniny, jako je voda a rtuťový kalx, vznikají při chemické kombinaci jednoho atomu s jinými atomy. To byl na svou dobu nesmírně pokročilý koncept; Daltonova teorie sice předpokládala, že se atomy spojují, ale trvalo více než 100 let, než vědci začali vysvětlovat koncept chemické vazby.
-
Když prvky reagují za vzniku sloučenin, reagují v definovaných, celočíselných poměrech. Pokusy, které Dalton a další prováděli, ukázaly, že reakce nejsou náhodné události; probíhají podle přesných a přesně definovaných vzorců. Tento důležitý koncept v chemii je podrobněji rozebrán níže.
Kontrolní bod porozumění
Prvek se skládá z
Některé podrobnosti Daltonovy atomové teorie vyžadují další vysvětlení.
Prvky: Již v roce 1660 Robert Boyle rozpoznal, že řecká definice prvku (země, oheň, vzduch a voda) není správná. Boyle navrhl novou definici prvku jako základní látky a nyní definujeme prvky jako základní látky, které nelze chemickými prostředky dále rozložit. Prvky jsou stavebními kameny vesmíru. Jsou to čisté látky, které tvoří základ všech materiálů kolem nás. Některé prvky můžeme vidět v čisté podobě, například rtuť v teploměru; některé vidíme hlavně v chemické kombinaci s jinými, například kyslík a vodík ve vodě. V současné době známe přibližně 116 různých prvků. Každý z prvků má svůj název a jedno- nebo dvoupísmennou zkratku. Často je touto zkratkou prostě první písmeno prvku; například vodík se zkracuje na H a kyslík na O. Někdy je prvek označen dvoupísmennou zkratkou; například helium je He. Při psaní zkratky prvku se první písmeno píše vždy s velkým písmenem a druhé písmeno (pokud existuje) se píše vždy s malým písmenem.
Atomy: Jednotlivá jednotka prvku se nazývá atom. Atom je nejzákladnější jednotkou hmoty, která tvoří vše ve světě kolem nás. Každý atom si zachovává všechny chemické a fyzikální vlastnosti svého mateřského prvku. Na konci devatenáctého století vědci prokáží, že atomy se ve skutečnosti skládají z menších, „subatomárních“ částí, což rozbije představu o atomu jako kulečníkové kouli (viz náš modul Atomová teorie I: Počátky).
Sloučeniny: Většina materiálů, se kterými přicházíme do styku, jsou sloučeniny, látky vzniklé chemickou kombinací dvou nebo více atomů prvků. Jednotlivá „částice“ sloučeniny se nazývá molekula. Dalton si nesprávně představoval, že se atomy „zaháknou“ za sebe a vytvoří molekuly. Dalton si však správně uvědomil, že sloučeniny mají přesné vzorce. Například voda se vždy skládá ze dvou částí vodíku a jedné části kyslíku. Chemický vzorec sloučeniny se zapisuje tak, že se uvedou symboly prvků dohromady, bez mezer mezi nimi. Pokud molekula obsahuje více než jeden atom prvku, je za symbolem uvedeno číslo, které udává počet atomů daného prvku v molekule. Vzorec vody je tedy H2O, nikdy ne HO nebo H2O2.
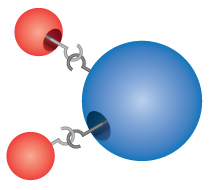
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.