10.13: Avogadro hipotézise és a moláris térfogat
Avogadro hipotézise és a moláris térfogat
A térfogat az anyag mennyiségének harmadik mérési módja a tételszám és a tömeg után. A folyadékok és szilárd anyagok esetében a térfogat az anyag sűrűségétől függően nagymértékben változik. Ennek az az oka, hogy a szilárd és folyékony részecskék szorosan egymás mellé tömörülnek, és a részecskék között nagyon kevés hely van. A gázok azonban nagyrészt a tényleges gázrészecskék közötti üres térből állnak (lásd az alábbi ábrát).
Amadeo Avogadro 1811-ben kifejtette, hogy minden gáz térfogata könnyen meghatározható. Avogadro hipotézise azt állítja, hogy azonos hőmérsékleten és nyomáson minden gáz azonos térfogata azonos számú részecskét tartalmaz. Mivel a gáz által elfoglalt teljes térfogatot elsősorban a részecskék közötti üres tér alkotja, maguknak a részecskéknek a tényleges mérete szinte elhanyagolható. Egy adott térfogatú, kisméretű, könnyű részecskéket tartalmazó gáz, például a hidrogén \(\left( \ce{H_2} \right)\) ugyanannyi részecskét tartalmaz, mint egy ugyanolyan térfogatú, nagy részecskéket tartalmazó nehéz gáz, például a kén-hexafluorid, \(\ce{SF_6}\).
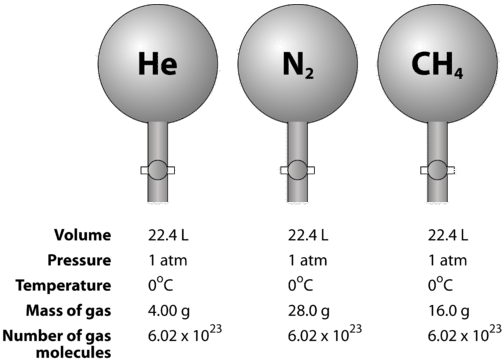
A gázok összenyomhatók, ami azt jelenti, hogy ha nagy nyomás alá helyezzük őket, a részecskék közelebb kerülnek egymáshoz. Ezáltal csökken az üres tér mennyisége, és csökken a gáz térfogata. A gázok térfogatát a hőmérséklet is befolyásolja. Ha egy gázt felmelegítünk, a molekulái gyorsabban mozognak, és a gáz kitágul. Mivel a gázok térfogata a nyomás és a hőmérséklet változása miatt változik, a gázok térfogatának összehasonlítását egy szabványos hőmérsékleten és nyomáson kell elvégezni. A standard hőmérséklet és nyomás (STP) meghatározása \(0^\text{o} \text{C}\) \(\left( 273,15 \: \text{K} \right)\) és \(1 \: \text{atm}\) nyomás. A gáz moláris térfogata a gáz egy móljának térfogata STP-nél. STP-n egy mól (\( 6,02 \szor 10^{23}\) reprezentatív részecske) bármely gázból \(22,4 \: \text{L}\) térfogatot foglal el (alábbi ábra).

Az alábbi ábra azt szemlélteti, hogy a moláris térfogat hogyan látható különböző gázok összehasonlításakor. A hélium \(\left( \ce{He} \right)\), a nitrogén \(\left( \ce{N_2} \right)\) és a metán \(\left( \ce{CH_4} \right)\) minták STP-n vannak. Mindegyik 1 mól vagy \(6,02 \szer 10^{23}\) részecskét tartalmaz. Az egyes gázok tömege azonban különböző, és megfelel az adott gáz moláris tömegének: \(4.00 \: \text{g/mol}\) a \(\ce{He}\), \(28.0 \: \text{g/mol}\) a \(\ce{N_2}\) és \(16.0 \: \text{g/mol}\) a \(\ce{CH_4}\) esetében.