19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- “R” group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Az egyes aminosavak az “R” csoportjuk tekintetében különböznek egymástól. Az aminosav “R” csoportja a molekula többi része, azaz az aminocsoporton, a savcsoporton és a központi szénatomon kívüli rész. Minden különböző aminosavnak egyedi “R” csoportja van, és az aminosav egyedi kémiai tulajdonságai az “R” csoportjától függnek (\(\PageIndex{1}\) ábra).
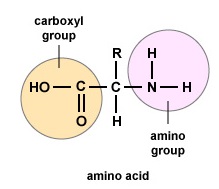
A polipeptidek és fehérjék kialakításához az aminosavakat peptidkötések kötik össze, amelyekben az egyik aminosav amino- vagy NH2-csoportja egy másik aminosav karboxil (sav)- vagy COOH-csoportjához kapcsolódik, amint azt az \(\(\PageIndex{2}\) és \(\PageIndex{3}\) ábra mutatja.)
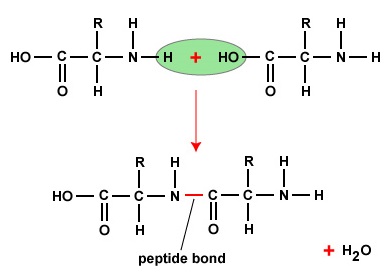
A peptid két vagy több aminosav, amelyek peptidkötéssel kapcsolódnak egymáshoz, a polipeptid pedig sok aminosavból álló lánc. Egy fehérje egy vagy több polipeptidet tartalmaz. A fehérjék tehát aminosavak hosszú láncai, amelyeket peptidkötések tartanak össze.
Az aminosavak tényleges sorrendjét a fehérjében elsődleges szerkezetnek nevezzük (\(\PageIndex{4}\ ábra)), és a DNS határozza meg. Amint azt később ebben az egységben látni fogjuk, a DNS géneknek nevezett funkcionális egységekre tagolódik. A gén a DNS egyik szálán található dezoxiribonukleotid bázisok olyan szekvenciája, amely egy funkcionális terméket – a hírvivő RNS, a transzfer RNS vagy a riboszómális RNS egy meghatározott molekuláját – kódolja. A termék általában hírvivő RNS (mRNS), és az mRNS végül egy polipeptid vagy fehérje szintézisét eredményezi. Ezért szokták azt mondani, hogy a génben lévő dezoxiribonukleotid bázisok sorrendje határozza meg egy adott fehérje aminosavsorrendjét. Mivel bizonyos aminosavak kölcsönhatásba léphetnek más aminosavakkal ugyanabban a fehérjében, ez az elsődleges szerkezet határozza meg végső soron a fehérje végső alakját és ezáltal kémiai és fizikai tulajdonságait.
A fehérje másodlagos szerkezetét az egyik aminosav oxigénatomja és a másik aminosav nitrogénatomja között kialakuló hidrogénkötések adják. Ez adja a fehérje vagy polipeptid kétdimenziós formáját, az alfa-hélixet vagy a béta-lapot (\(\PageIndex{5}\) ábra).
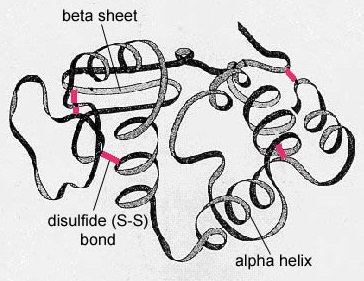
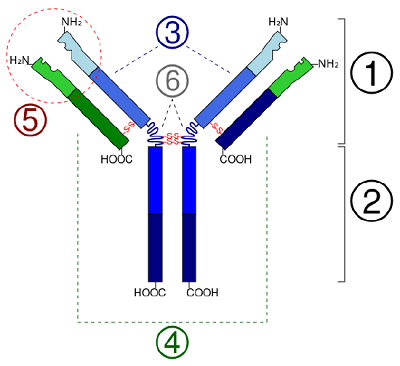
A globuláris fehérjékben, például az enzimekben, az aminosavak hosszú lánca háromdimenziós funkcionális formába vagy tercier szerkezetbe hajtódik. Ennek oka, hogy bizonyos szulfhidril- vagy SH-csoporttal rendelkező aminosavak diszulfid (S-S) kötéseket képeznek az azonos láncban lévő más aminosavakkal. Az aminosavak R-csoportjai közötti egyéb kölcsönhatások, például hidrogénkötések, ionos kötések, kovalens kötések és hidrofób kölcsönhatások szintén hozzájárulnak a tercier szerkezethez (\(\(\PageIndex{6}\) ábra). Egyes fehérjékben, például az antitestmolekulákban és a hemoglobinban több polipeptid is összekapcsolódhat, hogy kvaterner szerkezetet alkossanak (\(\PageIndex{7}\ ábra)).
Amint azt később látni fogjuk ebben az egységben, a fehérjeszintézis során a nukleotidbázisok sorrendje egy gén mentén átíródik az mRNS komplementer szálába, amelyet aztán a tRNS lefordít az adott polipeptid vagy fehérje aminosavainak megfelelő sorrendjébe. Ezért a dezoxiribonukleotid-bázisok sorrendje a DNS mentén meghatározza az aminosavak sorrendjét a fehérjékben. Mivel bizonyos aminosavak kölcsönhatásba léphetnek más aminosavakkal, az egyes fehérjék esetében az aminosavak sorrendje határozza meg a fehérje végső háromdimenziós alakját, ami viszont meghatározza az adott fehérje funkcióját (pl, milyen szubsztráttal reagál egy enzim, milyen epitópokhoz kapcsolódik egy antitest Fab-ja, milyen receptorokhoz kötődik egy citokin).
Összefoglaló
- A fehérjék építőkövei az aminosavak. A fehérjékben általában 20 különböző aminosav található, és gyakran 300 vagy több aminosav van fehérjemolekulánként.
- Minden aminosav tartalmaz egy amino- vagy NH2-csoportot és egy karboxil- (sav) vagy COOH-csoportot.
- A polipeptidek és fehérjék kialakításához az aminosavakat peptidkötésekkel kötik össze, amelyekben az egyik aminosav amino- vagy NH2-csoportja egy másik aminosav karboxil- (sav-) vagy COOH-csoportjához kapcsolódik.
- A peptid két vagy több aminosav, amelyek peptidkötésekkel kapcsolódnak össze; a polipeptid sok aminosavból álló lánc; a fehérje pedig egy vagy több polipeptidet tartalmaz. A fehérjék tehát peptidkötések által összetartott aminosavak hosszú láncai.
- A fehérjében lévő aminosavak tényleges sorrendjét elsődleges szerkezetnek nevezzük, és azt a DNS határozza meg.
- A génben lévő dezoxiribonukleotid bázisok sorrendje határozza meg egy adott fehérje aminosavsorrendjét. Mivel bizonyos aminosavak kölcsönhatásba léphetnek más aminosavakkal ugyanabban a fehérjében, ez az elsődleges szerkezet határozza meg végső soron a fehérje végső alakját és ezáltal kémiai és fizikai tulajdonságait.
- A fehérje másodlagos szerkezete az egyik aminosav oxigénatomja és a másik aminosav nitrogénatomja között kialakuló hidrogénkötéseknek köszönhető, és a fehérje vagy polipeptid kétdimenziós alfa-hélix vagy béta-lap alakját adja.
- A globuláris fehérjékben, mint például az enzimek, az aminosavak hosszú lánca háromdimenziós funkcionális alakba vagy tercier szerkezetbe hajtogatódik. Ennek oka, hogy bizonyos szulfhidril- vagy SH-csoporttal rendelkező aminosavak diszulfid (S-S) kötéseket képeznek az azonos láncban lévő más aminosavakkal. Az aminosavak R-csoportjai közötti egyéb kölcsönhatások, például hidrogénkötések, ionos kötések, kovalens kötések és hidrofób kölcsönhatások szintén hozzájárulnak a tercier szerkezethez.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)