2.3D: Elválasztáselmélet
Általános elmélet
A TLC kiváló analitikai eszköz a mintában lévő keverékek elválasztására. Ebben a fejezetben az elválasztás részleteit tárgyaljuk, és kibővítjük a 2.1.B.
A kromatográfia minden formájában a minták egyensúlyba kerülnek az álló és a mozgó fázis között. A TLC szinte minden alkalmazásánál az állófázis egy szilícium-dioxid vagy timföld adszorbens, a mozgófázis pedig egy szerves oldószer vagy oldószerkeverék (az “eluens”), amely felemelkedik a lemezen (3. egyenlet).
\
A szilikagél (a 2.16. ábrán látható) szilícium-oxigén kötések hálózatából áll, amelynek felületén \(\ce{O-H}\) kötések, valamint egy vízmolekulákból álló réteg található. A szilikagél \(\left( \ce{SiO_2} \cdot x \ce{H_2O} \right)\) a jelen tárgyalás során használt, de szerkezetileg analóg a timfölddel \(\left( \ce{Al_2O_3} \cdot x \ce{H_2O} \right)\). Ezt a nagyon poláros állófázist egy viszonylag nem poláros mozgófázissal (szerves oldószerrel vagy oldattal) párosítják, amit “normál fázisú” TLC-nek neveznek. Bár a TLC-nek ez a leggyakoribb formája (és ebben a fejezetben erre fogunk összpontosítani), néha használják a “fordított fázisú” TLC-t is (nem poláros állófázissal és poláros mozgófázissal).
A 2.16. ábra azt mutatja, hogyan tapadna az acetofenon a szilikagél felületéhez az intermolekuláris erők (IMF-ek) segítségével. Ebben az esetben az acetofenon az oxigénatomján keresztül hidrogénkötést (a 2.16a. ábrán jelzett IMF) tud kötni a szilícium-dioxid felületéhez. Ahogy az eluens átfolyik a mintán (2.16b. ábra), egyensúly jön létre az állófázison adszorbeálódó és a mozgófázisban oldódó minta között. A mozgófázisban a vegyület a folyadék áramlásával felfelé mozog a lemezen (2.16c. ábra), hogy később a lemezen feljebb lévő állófázison olvasszon fel. A vegyület eredő \(R_f\) értéke függ az álló és a mozgó fázisban töltött idő hosszától.
.png?revision=1&size=bestfit&width=1110&height=395)
A két fázis közötti egyensúlyi eloszlás több tényezőtől függ:
- A minta és az állófázis közötti intermolekuláris erők erősségétől függ.
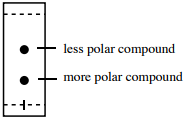
Az a vegyület, amely erős IMF-eket képez a szilícium-dioxiddal vagy timfölddel, gyakran az állófázist fogja előnyben részesíteni, és az elúciós idő nagy részét a lemezhez tapadva fogja tölteni. Ez azt jelenti, hogy kevesebb időt tölt a mozgófázisban (amely az egyetlen módja annak, hogy felfelé haladjon a lemezen), ami azt eredményezi, hogy a TLC lemezen alacsonyan helyezkedik el, és alacsony \(R_f\) értékkel rendelkezik.
Azoknak a vegyületeknek, amelyek oxigén- vagy nitrogénatomokkal rendelkeznek, képesnek kell lenniük hidrogénkötésre az állófázissal (erős IMF-jeik vannak az állófázissal), és így alacsonyabb \(R_f\) értékekkel rendelkeznek, mint a hasonló méretű vegyületek, amelyek csak a London diszperziós erők (LDF) révén képesek kölcsönhatásba lépni. - A minta és a mozgófázis közötti kölcsönhatás erősségétől függ.
Mivel normál fázisú TLC esetén a mozgófázis mindig kevésbé poláris, mint az állófázis, a poláris vegyületek általában kisebb affinitással rendelkeznek a mozgófázishoz, mint a nem poláris vegyületek (a “hasonló oldódik hasonlóan” elv alapján). Ezért a poláros vegyületek az elúciós időből kevesebbet töltenek mozgásban, mint a nem poláros vegyületek, így “lassabban” haladnak felfelé a lemezen, és alacsony \(R_f\) értékkel rendelkeznek.
A vegyületnek az álló és a mobil fázishoz való vonzódásának mértéke ugyanerre a következtetésre vezet:
- Minél erősebb IMF lehetséges az álló fázissal (gyakran minél több poláris funkciós csoport van a vegyületen), annál több ideig lesz a vegyület álló \(\rightarrow\) alacsonyabb \(R_f\).
- Minél több poláris funkciós csoport van egy vegyületen, annál kevésbé vonzódik a kevésbé poláris eluenshez, és annál kevesebb ideig lesz mobil \(\rightarrow\) alacsonyabb \(R_f\).
Az alacsonyabb \(R_f\) értékű vegyület tehát általában több poláris funkciós csoportot tartalmaz, mint a magasabb \(R_f\) értékű vegyület (összefoglalva a 2. ábrán.17).