4. Erős és gyenge bázisok
Gyenge bázisok
Az ammónia egy tipikus gyenge bázis. Maga az ammónia nyilvánvalóan nem tartalmaz hidroxidionokat, de vízzel reagálva ammóniumionok és hidroxidionok keletkeznek belőle.
\
A reakció azonban reverzibilis, és bármikor az ammónia mintegy 99%-a még mindig ammóniamolekulaként van jelen. Csak körülbelül 1%-ban keletkeztek ténylegesen hidroxidionok. A gyenge bázis olyan bázis, amely oldatban nem alakul át teljesen hidroxidionokká. Amikor egy gyenge bázis vízzel reagál, az egyensúlyi helyzet bázisonként változik. Minél balra van, annál gyengébb a bázis.
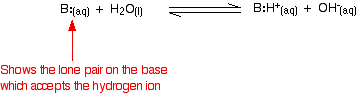
Az egyensúlyi helyzet mértékét a reakció egyensúlyi állandójának felírásával kaphatjuk meg. Minél alacsonyabb az állandó értéke, annál inkább balra van az egyensúly. Ebben az esetben az egyensúlyi állandó neve Kb. Ezt a következőképpen határozzuk meg:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other “p” terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |