A biológia alapjai
Miután megtanultuk, hogy a kémiai reakciók energiát szabadítanak fel, amikor az energiatároló kötések felbomlanak, egy fontos következő kérdés a következő: Hogyan számszerűsítik és fejezik ki az ezekkel a kémiai reakciókkal kapcsolatos energiát? Hogyan lehet összehasonlítani az egyik reakció során felszabaduló energiát egy másik reakcióéval? Az ilyen energiaátadások számszerűsítésére a szabad energia mérése szolgál. Emlékezzünk vissza, hogy a termodinamika második törvénye szerint minden energiaátadás bizonyos mennyiségű energia elvesztésével jár, amely hasznosíthatatlan formában, például hő formájában jelentkezik. A szabad energia kifejezetten azt a kémiai reakcióhoz kapcsolódó energiát jelenti, amely a veszteségek figyelembevétele után rendelkezésre áll. Más szóval a szabad energia a felhasználható energia, vagyis a munkára rendelkezésre álló energia. Ha ezt a fogalmat biológiai értelemben vizsgáljuk, a szabad energia a molekulán belüli, munkavégzésre felhasználható energia. A glükóznak sok szabad energiája van, mert a glükózmolekula kötéseiben sok energia van tárolva. A szén-dioxidnak sokkal kisebb a szabad energiája, mert sokkal kevesebb energia van a kötéseiben tárolva.
Ha egy kémiai reakció során energia szabadul fel, akkor a szabad energia változása a reaktánsoknak a termékekké való átalakulásakor, amelyet ΔG-vel (delta G) jelölünk, negatív szám lesz. A negatív szabadenergia-változás azt is jelenti, hogy a reakció termékeinek kevesebb a szabadenergiája, mint a reaktánsoknak, mert a reakció során szabad energiát szabadítanak fel. Azokat a reakciókat, amelyekben a szabad energia változása negatív, és ennek következtében szabad energia szabadul fel, exergonikus reakcióknak nevezzük. Gondolj bele: az exergonikus reakció azt jelenti, hogy energia távozik a rendszerből. Ezeket a reakciókat spontán reakcióknak is nevezik, és a termékeik kevesebb tárolt energiával rendelkeznek, mint a reaktánsok. Fontos különbséget kell tenni a spontán kifejezés és a kémiai reakció azonnali bekövetkezésének gondolata között. A kifejezés mindennapi használatával ellentétben a spontán reakció nem hirtelen vagy gyorsan bekövetkező reakció. A vas rozsdásodása példa a spontán reakcióra, amely lassan, apránként, idővel játszódik le.
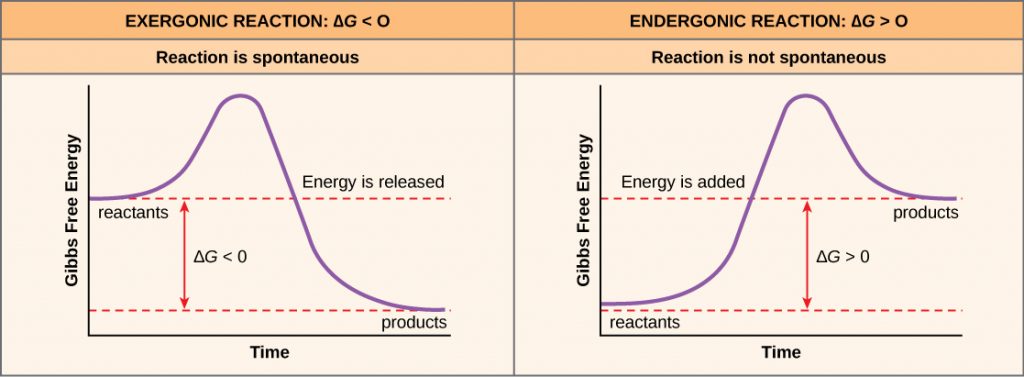
Ha egy kémiai reakció egyensúlyban inkább energiát vesz fel, mint energiát ad le, akkor a reakció ΔG értéke pozitív lesz. Ebben az esetben a termékeknek több szabad energiájuk van, mint a reaktánsoknak. Így az ilyen reakciók termékei energiatároló molekuláknak tekinthetők. Ezeket a kémiai reakciókat endergonikus reakcióknak nevezzük, és ezek nem spontán reakciók.
Egy endergonikus reakció nem megy végbe magától, szabad energia hozzáadása nélkül.

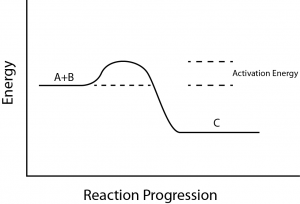
Az endergonikus és exergonikus reakciókkal kapcsolatban egy másik fontos fogalmat is figyelembe kell venni. Az exergonikus reakcióknak kis mennyiségű energiabevitelre van szükségük ahhoz, hogy beinduljanak, mielőtt folytatódhatnak az energiát felszabadító lépések.
Ezek a reakciók nettó energiafelszabadulással járnak, de az elején még mindig szükség van némi energiabevitelre. Ezt a kis mennyiségű energiabevitelt, amely minden kémiai reakció bekövetkezéséhez szükséges, aktiválási energiának nevezzük (3. ábra).
Az oldalon található képek – eltérő megjelölés hiányában – az OpenStax által CC-BY 4.0 licenc alatt állnak.
A szöveg a következő forrásból származik: OpenStax, Concepts of Biology. OpenStax CNX. 2016. május 18. http://cnx.org/contents/[email protected]