Adipociták
Az adipociták a szervezet fő energiatároló helyei, és kritikus endokrin funkciókat is ellátnak. Ezért az adipociták fejlődésének és működésének megértése – különösen az elhízás világjárványának fényében – elengedhetetlen a metabolikus homeosztázis megértéséhez. A zsírsejteknek két általános osztálya van; a fehér zsírsejtek – amelyek egyetlen nagy lipidcsepp formájában tárolják az energiát, és fontos endokrin funkciókkal rendelkeznek, valamint a barna zsírsejtek – amelyek több kis lipidcseppben tárolják az energiát, de kifejezetten a testhő előállítására szolgáló üzemanyagként (azaz a termogenezisre). A barna zsírsejtek hőtermelését a mitokondriális lokalizált uncoupling protein 1 (Ucp1) egyedülálló expressziója teszi lehetővé. Ezek az osztályozások azonban túlságosan leegyszerűsítettek, mivel egyes fehér adipociták a hőmérséklettől és az étrendtől függően felvehetik a barna adipociták jellemzőit (brite vagy beige adipocitáknak nevezik őket) és fordítva. Érdekel bennünket a különböző adipociták eredetének megértése, valamint a fejlődésüket, eloszlásukat és működésüket szabályozó jelátviteli és metabolikus útvonalak meghatározása.
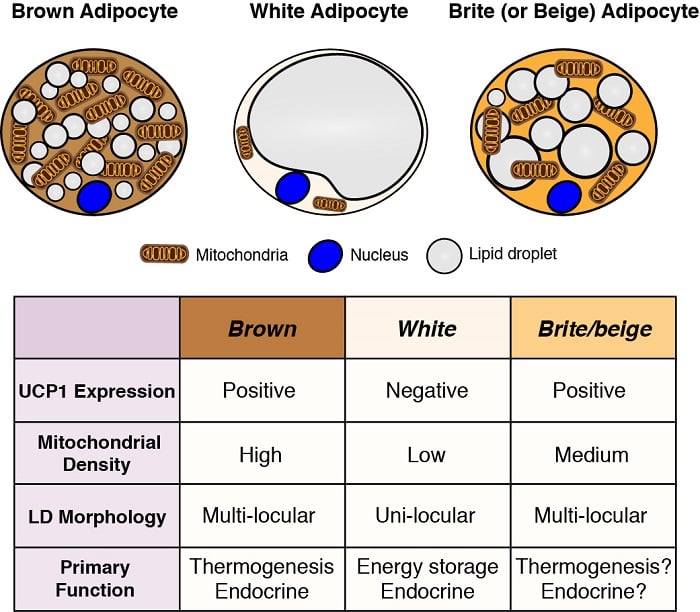
Az adipociták eredete
A zsírszövet egészségben és betegségben betöltött szerepének megértéséhez elengedhetetlen annak megértése, hogyan növekszik, és ebből a szempontból a zsírszövet biológiájának egyik legkevésbé megértett területe a különböző típusú adipociták fejlődési eredete. A zsírsejtek eredetének meghatározása segíthet megmagyarázni az emberi test zsíreloszlási mintázatát, különösen az elhízott vagy lipodisztrófiás egyéneknél, és nyomokat adhat az egyes zsírdepók között megfigyelhető metabolikus különbségekhez. Az adipocita prekurzor sejtek és a terjeszkedésüket szabályozó mechanizmusok azonosítása szintén kritikus fontosságú az egészséges zsírszöveti működés megértéséhez és kezeléséhez. Lehetséges lehet az “egészséges” adipociták (például barna vagy brite/bézs adipociták) prekurzorokból történő kifejlesztése is a sejtalapú terápiákhoz, amelyek célja alapvetően a zsír zsírral a zsír ellen való küzdelem. Genetikai és vonalkövetési stratégiák kombinációjával korábban feltérképeztük a különböző depókban található adipociták eredetét. Eredményeink váratlan mértékű heterogenitást mutatnak, amely összhangban van a többféle fejlődési eredettel rendelkező adipocitákkal, és alátámaszt egy olyan modellt, amelyben az adipociták sorsa valószínűleg mind extrinsic, mind intrinsic tényezőktől függ.
Az adipocitáknak többféle fejlődési eredete van
(balra lent) A zsírszöveti depók anatómiai eloszlása egérben. A barna zsírszövet (BAT) és a fehér zsírszövet (WAT) depók láthatóak. (jobbra lent) Példa egy vonalkövetési kísérletre, amelynek során a fejlődési elősejteket és valamennyi utódsejtjüket kitörölhetetlenül megjelölték a Myf5 (a panel) vagy a Pax3 (b panel) expressziójához kapcsolódó fluoreszcens jelöléssel. A zölddel (mGFP) jelölt zsírsejtek más prekurzor sejtből származnak, mint a pirossal (mTFP) jelölt zsírsejtek.
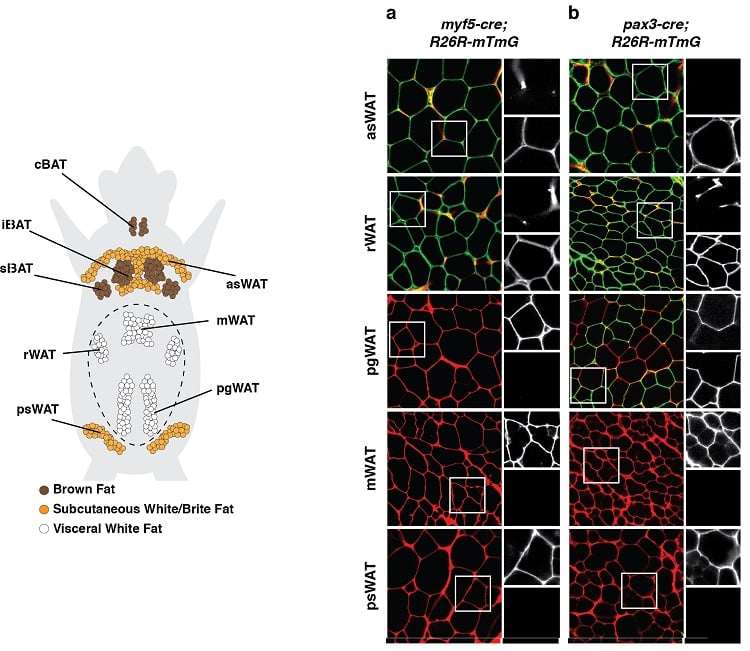
Az ilyen eredmények arra utalnak, hogy a zsírsejtek többféle fejlődési eredetűek.
(adaptálva Sanchez-Gurmaches & Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016) alapján.
A barna adipociták
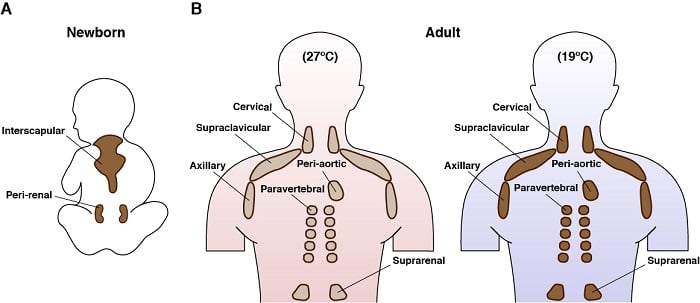
A barna adipociták lenyűgöző sejtek. Csak emlősökben léteznek, és fő funkciójuk az endogén hőtermelés a termogenezisnek nevezett folyamat során. Ezt az uncoupling protein 1 (UCP1) nevű mitokondriális membránfehérje egyedülálló expressziója teszi lehetővé. A barna zsír energiafelhasználó tulajdonságai, és az a közelmúltbeli felismerés, hogy a felnőtt emberek is rendelkeznek barna zsírral, a túltápláltság elleni küzdelemre irányuló terápiák célpontjává tette őket. Az aktív barna zsírsejtek az egyik legérdekesebb anyagcsereprogrammal is rendelkeznek: egyszerre vesznek fel és fogyasztanak nagy mennyiségű különböző tápanyagot (pl. glükózt, lipideket, aminosavakat), és egyszerre képesek anabolikus és katabolikus anyagcserét is folytatni. Például mi és mások korábban kimutattuk, hogy a hidegtől stimulált BAT széles körben felszabályoz egy olyan genetikai programot, amely a zsírsav-oxidációs útvonalak mellett a de novo lipidszintézis útvonalakat is támogatja . Szeretnénk többet megérteni erről a figyelemre méltó és paradox anyagcseréről.
Tudjon meg többet a barna zsírszövet fejlődéséről és anyagcseréjéről
A barna zsírszövet anatómiai elhelyezkedése az emberben
Génmodellekkel azt is vizsgáljuk, hogy a jelátviteli útvonalak hogyan szabályozzák a BAT anyagcseréjét. Egerek segítségével például genetikailag töröltük a Rictort – amely az mTORC2 egy egyedi és alapvető fontosságú komponensét kódolja – csak a barna zsírszövetben. Tudjon meg többet az mTORC2-ről. Figyelemre méltó módon ezek az egerek védettek a magas zsírtartalmú étrenddel szemben. Pontosabban, a BAT Rictor-t nélkülöző egerek nem halmoztak fel túlzott mennyiségű lipidet a májukban vagy a zsigeri zsírszöveti depóikban, amikor magas zsírtartalmú étrendet fogyasztottak . Ez izgalmas eredmény, mivel a túlzott zsírraktározás ezeken a helyeken veszélyesen egészségtelen. A genetika, a genomika, a metabolizmus és a biokémia kombinációjával próbáljuk megérteni, hogy ezek az egerek miért védettek a magas zsírtartalmú étrenddel szemben.
Fehér adipociták
A fehér adipociták az emberben a legnagyobb mennyiségben előforduló adipociták. A fehér zsírszöveti depók figyelemre méltó képességgel rendelkeznek a terjeszkedésre és az energiatárolásra is, és jeleznek az agy és más szövetek felé, hogy erősen befolyásolják a táplálkozási viselkedést és a metabolikus homeosztázist. Bár azonban a fehér zsírsejtek kifejezetten alkalmazkodtak a felesleges tápanyagok biztonságos elzárásához, van egy olyan fordulópontjuk (pl. elhízás esetén), ahol jótékony funkcióik csődöt mondanak, és ez erősen elősegíti az anyagcsere-betegségek és a 2-es típusú cukorbetegség kialakulását. Mi határozza meg a fordulópontot? Hogyan jeleznek a fehér zsírsejtek más szöveteknek? Mennyire heterogének a fehér zsírszöveti depók? Miért károsabb az egészségre a zsigeri zsírfelesleg, mint a bőr alatti zsírfelesleg? Ezek mind olyan nyitott kérdések, amelyek érdekelnek bennünket.
Az mTOR jelátvitelt is vizsgáljuk a fehér zsírsejtekben. Az mTOR az inzulin jelátvitel egyik fő downstream célpontja, amely a fő hormon, amelyre a zsírsejtek reagálnak. Genetikai egérmodellek segítségével szelektíven gátoltuk az mTORC1-et vagy az mTORC2-t az összes adipocitában. Az mTORC1 gátlása a fehér zsírszövetben inzulinrezisztenciával és zsírmájbetegséggel járó lipodisztrófiához hasonló szindrómát okoz. Az mTORC2 gátlása a fehér zsírszövetben szintén inzulinrezisztenciát okoz, de a zsírszövet tömegének változásától függetlenül. Az utóbbi modellben úgy tűnik, hogy az mTORC2 egy olyan, a zsírsejtekből származó jelet szabályoz, amely a májjal kommunikálva szabályozza a máj glükóztermelését. E fenotípusok mechanisztikus alapjainak megértése kritikus információkat fog nyújtani arról, hogy a tápanyagérzékelő jelátviteli útvonalak hogyan járulnak hozzá a zsírszövethez kapcsolódó betegségek patogeneziséhez.
A mTORC2 jelátvitel modellje fehér adipocitában
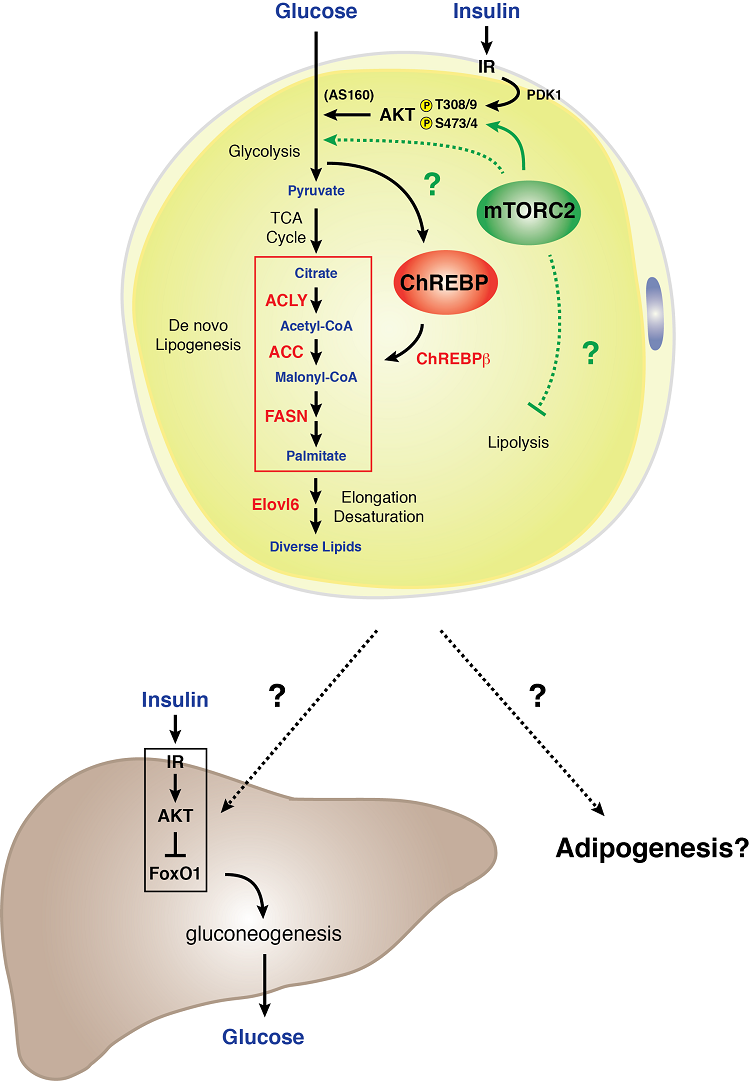 A fehér adipocitáknak szükségük van az mTORC2-re a normális szénhidrát- és lipidanyagcseréhez. Azt találtuk, hogy a Rictor (mTORC2) genetikai elvesztése specifikusan fehér adipocitákban csökkenti a glükózfelvételt és gyengíti a ChREBP-béta transzkripciós faktor és downstream célpontjainak – amelyek közé tartoznak a de novo lipogenezis útvonalában működő enzimek – expresszióját. Ezenkívül az mTORC2 hiánya a fehér zsírsejtekben súlyos hepatikus inzulinrezisztenciát eredményez. Ezek az adatok azt jelzik, hogy a fehér zsírsejtek mTORC2 a szénhidrát- és lipidanyagcsere alapvető szabályozója, és kulcsfontosságú összetevője egy extrahepatikus tápanyag-érzékelő szervi kommunikációs mechanizmusnak, amely szabályozza a szisztémás glükóz homeosztázist . Az mTORC2 jelátvitel biológiájának megértése a fehér zsírban fontos nyomokat rejthet ahhoz, hogy a fehér zsírszövet hogyan működik glükózérzékelő szervként és a szisztémás metabolikus fittség közvetítőjeként.
A fehér adipocitáknak szükségük van az mTORC2-re a normális szénhidrát- és lipidanyagcseréhez. Azt találtuk, hogy a Rictor (mTORC2) genetikai elvesztése specifikusan fehér adipocitákban csökkenti a glükózfelvételt és gyengíti a ChREBP-béta transzkripciós faktor és downstream célpontjainak – amelyek közé tartoznak a de novo lipogenezis útvonalában működő enzimek – expresszióját. Ezenkívül az mTORC2 hiánya a fehér zsírsejtekben súlyos hepatikus inzulinrezisztenciát eredményez. Ezek az adatok azt jelzik, hogy a fehér zsírsejtek mTORC2 a szénhidrát- és lipidanyagcsere alapvető szabályozója, és kulcsfontosságú összetevője egy extrahepatikus tápanyag-érzékelő szervi kommunikációs mechanizmusnak, amely szabályozza a szisztémás glükóz homeosztázist . Az mTORC2 jelátvitel biológiájának megértése a fehér zsírban fontos nyomokat rejthet ahhoz, hogy a fehér zsírszövet hogyan működik glükózérzékelő szervként és a szisztémás metabolikus fittség közvetítőjeként.