H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
H2S Lewis-szerkezete
Minden vegyület Lewis-szerkezete a kötés kialakításában részt vevő valenciaelektronok és a nem kötő elektronpárok szerkezeti ábrázolása. Egy adott kémiai vegyület Lewis-szerkezetének ismerete alapvető fontosságú, mivel ez adja meg a szükséges információkat a vegyület összes többi kémiai tulajdonságáról.
Az ábrázolás az elektronokat jelképező pontok és vonalak segítségével jelenik meg. A pontok azokat az elektronokat jelölik, amelyek nem vesznek részt a kötésképzésben. Míg a vonalak a vegyületben lévő kötéseket ábrázolják. A szerkezet az oktett-szabály alapján készül. A kémia oktett-szabálya kimondja, hogy egy elem külső héjában nyolc elektronnak kell lennie ahhoz, hogy stabil legyen.
A hidrogén-szulfid Lewis-szerkezete könnyen rajzolható és érthető. Ebben a vegyületben mindkét hidrogénatomnak egy-egy elektronra van szüksége a kovalens kötés kialakításához a kénnel. A H2S Lewis-szerkezete hasonló a H2S-hez. A kénnek nyolc elektronra van szüksége az oktett-szabály követelményeinek teljesítéséhez. A hidrogénnek azonban csak egyetlen elektronra van szüksége ahhoz, hogy stabil legyen, mivel az 1. csoportba tartozó elemek közé tartozik.
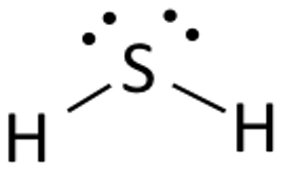
Tegyük a kénatomot középre, és rendezzük köré a valenciaelektronokat.
Ezután helyezzünk két hidrogénatomot a központi atom két oldalára.
Itt a kén valenciaelektronjait arra használjuk, hogy a hidrogént stabillá tegyük azáltal, hogy egy-egy elektront adunk mindkét hidrogénatomnak. A hat valenciaelektronból kettő vesz részt a kötés kialakításában.
Rajzolj vonalakat ( a kötések ábrázolására) a hidrogén- és a kénatomok közé.
A fennmaradó négy elektron nem kötő elektron, ezért a kénatom közelében pontokként ábrázoljuk őket. Összesen két pár nem kötő elektron van ebben a vegyületben, és a hidrogénatomok teljes valenciahéjjal rendelkeznek.
H2S hibridizáció
A H2S hibridizációjának megértéséhez először két dolgot kell feltétlenül tudnunk:
- A vegyületben lévő kötések száma és típusa
A hibridizáció megismeréséhez elengedhetetlen a vegyületben lévő kötés típusának ismerete. A H2S molekulában két hidrogénatom kötést alkot a központi kénatomhoz. A molekulában két egyszerű kötés jön létre. Ezek a kötések négy valenciaelektront vesznek fel, és így négy másik valenciaelektron marad. A kötés kialakításakor a hidrogénatom s orbitálja átfedésben van a kénatom p orbitáljával. A magányos elektronpár két sp3 pályát foglal el. Az sp3 másik két pályája átfedésben van a hidrogénatom 1s pályájával.
Ez az elrendeződés a H2S molekula sp3 hibridizációjához vezet. A két hibrid pálya átfedése két szigma kötést alakít ki a hidrogén- és a kénatom között.
- Az adott vegyület sztérikus száma
A sztérikus számot a központi atom körül látható elektronsűrűség régiójaként határozzuk meg. Ebben az esetben, mivel a központi atom a kén, a vegyület sztérikus száma a központi atomhoz kötött atomok összesített száma és a központi atom körüli magányos elektronpárok száma lesz.
A szám meghatározásának képlete:
Szterikus szám (SN)
= A központi atomon lévő szigma kötések száma +A központi atomon lévő pi magányos párok száma
A H2S molekulák esetében két szigma kötés van, és két magányos elektronpár van a központi atomon.

Így a H2S molekula SN értéke = 2+2
=4
Mivel a H2S sztérikus száma négy, két
hibrid pályája és két magányos elektronpárja van, ami sp3 hibridizációvá teszi.
Most, hogy ismerjük a molekula Lewis-szerkezetét és hibridizációját, könnyű meghatározni a molekulageometriáját.
H2S molekulageometria
A H2S adott molekulájának hibridizációja sp3; a kénatom középponti kötésben van két hidrogénatomhoz, amelyek 180 foknál kisebb kötésszöget alkotnak. A VSEPR elmélet szerint a magányos elektronpárok taszítják egymást, de mivel a Kénatom kevésbé elektronegatív, a kötésszög 104,5 fokra csökken.
Ez a szögcsökkenés hajlított szerkezethez vezet.
A molekulageometria megismerésének másik módja az AXN módszer. Ahol A a központi atomot, X a kötésszámú elektronpárt, N pedig a magányos elektronpárt jelöli. Itt az általános képlet a két kötéspár és a két magányos elektronpár miatt AX2N2 lesz. Ez a molekula tehát hajlított geometriát mutat.
H2S polaritása
Most, hogy már rendelkezünk a szükséges információkkal a molekuláról, könnyű meghatározni a polaritását. Bármely adott molekula polaritása függ a molekulageometriától és az általános elektronegativitástól. Mivel a kénatom kevésbé elektronegatív, a vegyület teljes elektronegativitása kisebb, mint 0,4, így nem poláris.
Így elmondható, hogy a H2S molekula nem poláris.
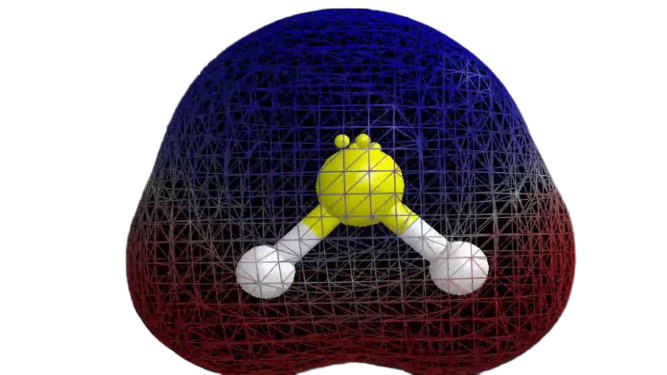
Következtető megjegyzések
A fenti információkból megállapítható, hogy a H2S molekula nyolc valenciaelektronnal rendelkezik, sp3 hibridizációval, hajlított molekulageometriával, és nem poláris.