Kémia nem szakmabelieknek
Learning Objectives
- Definiálja az atomsugarat.
- Írd le, hogyan változik az atomsugár egy perióduson belül.
- Írd le, hogyan változik az atomsugár egy csoporton belül.
Hogyan fér el ennyi ember ilyen kis helyen?
 A rendezvények nagyszámú embert vonzanak. Még egy szabadtéri rendezvény is megtelhet úgy, hogy nincs hely több embernek. A tömeg befogadóképessége a helyszínben rendelkezésre álló hely nagyságától függ, a hely nagysága pedig az azt megtöltő tárgyak méretétől. Egy adott térben több embert tudunk elhelyezni, mint elefántot, mert az elefántok nagyobbak, mint az emberek. Ugyanezen okból kifolyólag több mókust tudunk ugyanabba a térbe beültetni, mint embert. A tárgyak méretének ismerete fontos lehet annak eldöntésében, hogy mekkora térre van szükségünk.
A rendezvények nagyszámú embert vonzanak. Még egy szabadtéri rendezvény is megtelhet úgy, hogy nincs hely több embernek. A tömeg befogadóképessége a helyszínben rendelkezésre álló hely nagyságától függ, a hely nagysága pedig az azt megtöltő tárgyak méretétől. Egy adott térben több embert tudunk elhelyezni, mint elefántot, mert az elefántok nagyobbak, mint az emberek. Ugyanezen okból kifolyólag több mókust tudunk ugyanabba a térbe beültetni, mint embert. A tárgyak méretének ismerete fontos lehet annak eldöntésében, hogy mekkora térre van szükségünk.
Az atomok mérete fontos, amikor az atomok vagy vegyületek viselkedését próbáljuk megmagyarázni. Az atomok méretét többek között az atomsugárral tudjuk kifejezni . Ez az adat segít megérteni, hogy miért illeszkednek egymáshoz egyes molekulák, és miért vannak olyan részei más molekuláknak, amelyek bizonyos körülmények között túl zsúfoltak.
Az atom méretét az orbitális szélével határozzuk meg. Az orbitális határok azonban homályosak, és valójában különböző körülmények között változóak. Az atomsugarak mérésének szabványosítása érdekében két azonos, egymáshoz kötött atom magjainak távolságát mérik. Az atomsugarat az egymással összekapcsolt, azonos atomok atommagjai közötti távolság feleként határozzák meg.

1. ábra. Egy atom atomsugara (r) úgy határozható meg, mint a két atommag közötti távolság (d) fele egy kétatomos molekulában.
Az elemeknél már mértek atomsugarakat. Az atomi sugarak mértékegysége pikométer, ami 10-12 méterrel egyenlő. Példaként egy H2-molekulában a két hidrogénatom közötti atomon belüli távolságot 74 pm-nek mérik. Ezért a hidrogénatom atomsugara \frac{74}{2}=37\text{ pm}.
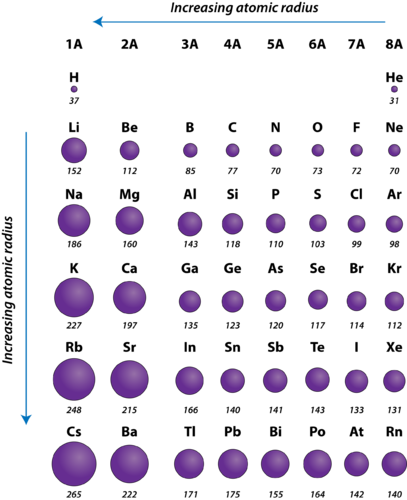
2. ábra. A reprezentatív elemek atomsugarai pikométerben mérve.
Periódusos tendencia
Az atomok atomsugara általában balról jobbra csökken egy perióduson keresztül. Vannak kisebb kivételek, például az oxigén sugara valamivel nagyobb, mint a nitrogéné. Egy perióduson belül a protonok hozzáadódnak az atommaghoz, miközben az elektronok ugyanarra a fő energiaszintre kerülnek. Ezek az elektronok fokozatosan közelebb húzódnak az atommaghoz annak megnövekedett pozitív töltése miatt. Mivel az atommagok és az elektronok közötti vonzóerő növekszik, az atomok mérete csökken. A hatás csökken, ahogy egy perióduson belül egyre jobbra haladunk, mivel az elektron-elektron taszítás miatt egyébként az atom mérete növekedne.
Group Trend
Az atomok atomsugara egy csoporton belül általában felülről lefelé növekszik. Ahogy az atomszám egy csoportban lefelé növekszik, úgy növekszik ismét a pozitív magtöltés. Ugyanakkor növekszik a foglalt elvi energiaszintek száma is. A magasabb fő energiaszintek olyan pályákból állnak, amelyek nagyobb méretűek, mint az alacsonyabb energiaszintek pályái. A nagyobb számú fő energiaszintek hatása ellensúlyozza a magtöltés növekedését, és így az atomsugár egy csoporttal lejjebb növekszik.

3. ábra. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define “atomic radius.”
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.