Korai elképzelések az anyagról: Demokritosztól Daltonig
Modern atomelmélet

Priestley, Lavoisier és mások lefektették a kémia alapjait. Kísérleteik kimutatták, hogy egyes anyagok egyesülni tudnak másokkal, hogy új anyagokat alkossanak, más anyagok szétbonthatók, hogy egyszerűbbeket alkossanak, és néhány kulcsfontosságú “elem” nem bontható tovább. De mi lehetett a magyarázat erre az összetett megfigyeléshalmazra? John Dalton, egy kivételes brit tanár és tudós összerakta a darabokat, és 1803-ban kidolgozta az első modern atomelméletet. Ha többet szeretnél megtudni Priestley és Lavoisier kísérleteiről, valamint arról, hogy ezek hogyan képezték Dalton elméleteinek alapját, próbáld ki az alább linkelt interaktív kísérletet Dalton játszóháza.
Dalton rendszeres szokásává tette, hogy nyomon követi és feljegyzi szülővárosában, az angliai Manchesterben az időjárást. A reggeli köd és más időjárási minták megfigyelései révén Dalton rájött, hogy a víz létezhet gázként, amely keveredik a levegővel, és ugyanazt a teret foglalja el, mint a levegő. A szilárd testek nem foglalhatták el ugyanazt a teret, például a jég nem keveredhetett a levegővel. Mi tehette tehát lehetővé, hogy a víz néha szilárd anyagként, néha pedig gázként viselkedjen? Dalton rájött, hogy minden anyagnak apró részecskékből kell állnia. Gázállapotban ezek a részecskék szabadon lebegnek és keveredhetnek más gázokkal, ahogy Bernoulli javasolta. Dalton azonban kiterjesztette ezt az elképzelést az összes anyagra – gázokra, szilárd és folyékony halmazállapotú anyagokra -. Dalton először 1803-ban terjesztette elő atomelméletének egy részét, majd később továbbfejlesztette ezeket az elképzeléseket az 1808-as A New System of Chemical Philosophy (A kémiai filozófia új rendszere) című klasszikus tanulmányában (amelyhez a Források fül alatt található linken keresztül juthat el).
Dalton elméletének négy fő fogalma volt:
-
Minden anyag oszthatatlan részecskékből, úgynevezett atomokból áll. Bernoulli, Dalton és mások az atomokat különböző mozgási állapotú, apró, biliárdgolyószerű részecskéknek képzelték el. Bár ez az elképzelés hasznos az atomok megértéséhez, nem helytálló, amint azt a modul alján linkelt későbbi atomelméleti modulokban látni fogjuk.
-
Egy adott elem minden atomja azonos; a különböző elemek atomjai különböző tulajdonságokkal rendelkeznek. Dalton elmélete azt sugallta, hogy egy elem, például az oxigén minden egyes atomja azonos minden más oxigénatoméval; továbbá a különböző elemek atomjai, például az oxigén és a higany atomjai különböznek egymástól. Dalton az elemeket atomsúlyuk alapján jellemezte; amikor azonban az 1800-as évek végén felfedezték az elemek izotópjait, ez az elképzelés megváltozott.
-
A kémiai reakciók az atomok kombinációjával, nem pedig az atomok megsemmisítésével járnak. Az atomok elpusztíthatatlanok és megváltoztathatatlanok, így a vegyületek, mint például a víz és a higanykalcium, akkor keletkeznek, amikor egy atom kémiailag egyesül más atomokkal. Ez a korban rendkívül fejlett elképzelés volt; bár Dalton elmélete azt sugallta, hogy az atomok összekapcsolódnak, több mint 100 évnek kellett eltelnie ahhoz, hogy a tudósok elkezdjék megmagyarázni a kémiai kötés fogalmát.
-
Amikor az elemek vegyületeket alkotva reagálnak, meghatározott, egész számok szerinti arányban reagálnak. A Dalton és mások által végzett kísérletek megmutatták, hogy a reakciók nem véletlenszerű események, hanem pontos és jól meghatározott képletek szerint zajlanak. A kémia e fontos fogalmát az alábbiakban részletesebben tárgyaljuk.
Megértés-ellenőrzési pont
Egy elemet
Dalton atomelméletének néhány részlete további magyarázatra szorul.
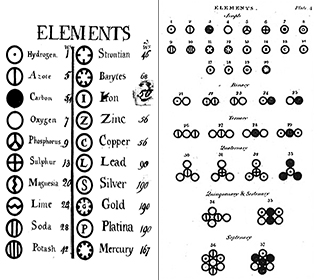
Elemek: Robert Boyle már 1660-ban felismerte, hogy az elem görög meghatározása (föld, tűz, levegő és víz) nem helyes. Boyle új definíciót javasolt az elemre, mint alapvető anyagra, és ma az elemeket olyan alapvető anyagokként határozzuk meg, amelyek kémiai úton nem bonthatók tovább. Az elemek a világegyetem építőkövei. Olyan tiszta anyagok, amelyek a körülöttünk lévő összes anyag alapját képezik. Néhány elemet tiszta formában láthatunk, mint például a higanyt a hőmérőben; néhányat főként másokkal való kémiai kombinációban látunk, mint például az oxigént és a hidrogént a vízben. Jelenleg körülbelül 116 különböző elemet ismerünk. Mindegyik elemnek van egy neve és egy egy- vagy kétbetűs rövidítése. Gyakran ez a rövidítés egyszerűen az elem első betűje; például a hidrogén rövidítése H, az oxigéné pedig O. Néha egy elem kétbetűs rövidítést kap; például a héliumé He. Amikor egy elem rövidítését írjuk, az első betűt mindig nagybetűvel, a második betűt (ha van) pedig mindig kisbetűvel írjuk.
Atomok: Egy elem egyetlen egységét atomnak nevezzük. Az atom az anyag legalapvetőbb egysége, amely mindent alkot a minket körülvevő világban. Minden atom megtartja a szülőelem minden kémiai és fizikai tulajdonságát. A XIX. század végén a tudósok kimutatták, hogy az atomok valójában kisebb, “szubatomi” darabokból állnak, ami megdöntötte az atomról alkotott biliárdgolyós elképzelést (lásd az Atomelmélet I: A kezdetek modulunkat).
Vegyületek: A legtöbb anyag, amellyel kapcsolatba kerülünk, vegyületek, olyan anyagok, amelyek az elemek két vagy több atomjának kémiai kombinációjából keletkeznek. Egy vegyület egyetlen “részecskéjét” molekulának nevezzük. Dalton tévesen úgy képzelte, hogy az atomok “összeakadva” alkotnak molekulákat. Dalton azonban helyesen ismerte fel, hogy a vegyületek pontos képletekkel rendelkeznek. A víz például mindig két rész hidrogénből és egy rész oxigénből áll. Egy vegyület kémiai képletét úgy írjuk fel, hogy az elemek szimbólumait egymás mellé soroljuk, szóközök nélkül. Ha egy molekula egynél több elem atomját tartalmazza, akkor a szimbólum után egy számot írunk, amely megmutatja, hány atomja van az adott elemnek a molekulában. Így a víz képlete H2O, soha nem HO vagy H2O2.
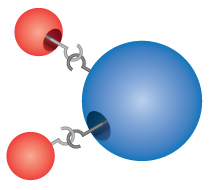
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.