Lyme-kór
Áttekintés
A humán anaplazmózis első esetét 1990-ben írták le, amikor egy wisconsini betegnél egy kullancscsípést követően súlyos lázas betegség alakult ki, és két héttel később meghalt. A vérkenetek a beteg neutrofil sejtjeiben baktériumcsomókat mutattak ki, hasonlóan az E. chaffeensis fertőzés esetén a monocitákban megfigyelhető morulákhoz. Az E. chaffeensis tenyésztése és szerológiai vizsgálata azonban negatív volt. Mindazonáltal a beteg klinikai lefolyása valamilyen ehrlichiosisra utalt, és amikor a következő években a betegség számos további esetét jelentették az északi Középnyugaton, felmerült a feltételezés, hogy egy új Ehrlichia-faj van kialakulóban. Az új betegségnek ideiglenesen a “humán granulocitikus ehrlichiosis” vagy HGE nevet adták.
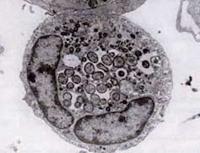
1994-ben a DNS-szekvenálási vizsgálatok kimutatták, hogy a HGE kórokozója egyértelműen különbözik az E. chaffeensis-től, de lényegében azonos két korábban ismert ehrlichiális állatpatogénnel, az E. equi-vel és az E. (Cytoecetes) phagocytophila-val. Az azóta bevezetett új rendszertani rendszer szerint ezt a három szervezetet egyetlen fajként egyesítették egy új nemzetségben, az Anaplasma nemzetségben. Az új faj neve Anaplasma phagocytophilum, az általa okozott betegséget pedig humán granulocitikus anaplazmózisnak, azaz HGA-nak nevezik.
Az Ehrlichia fajokhoz hasonlóan az Anaplasma szervezetek kicsik, gram-negatívak és intracellulárisak. Az A. phagocytophilum a neutrofileket veszi célba, megváltoztatja azok működését a gazdaszervezetben, és vakuolumokban morulákat képez. Úgy tűnik, hogy az általa okozott károk nagy része a gazdaszervezet gyulladásos folyamataihoz kapcsolódik, mivel kevés bizonyíték van az organizmusok száma és a gazdaszervezet betegségének súlyossága közötti összefüggésre.
Az anaplazmózis globális fertőzés, amely Észak-Amerikában, Európa nagy részén és Kelet-Ázsiában fordul elő. A vektorok az Ixodes persulcatus-komplexbe tartozó kullancsok: I. scapularis az Egyesült Államok északkeleti és felső középnyugati régióiban; I. pacificus a csendes-óceáni északnyugaton; I. ricinus Európában; és I. persulcatus Ázsiában. Az A. phagocytophilum a természetben e kullancsok és különböző kisemlősök, elsősorban egerek és más kisrágcsálók közötti körforgás révén marad fenn. Mivel az Ixodes-kullancsok a Lyme-kór, a babesiosis és a kullancsencephalitis vektorai is, az emberekben előfordulhat és elő is fordul az Anaplasma és e többi betegség együttes fertőzése.
Az Egyesült Államokban a HGA esetei meghaladják a humán monocitikus ehrlichiosis (HME) eseteit.
Tünetek és tünetek
A HGA klinikai lefolyása a HME-hez és a humán ewingii ehrlichiosishoz hasonlóan a HGA-ban szenvedő betegek átlagéletkora 50 év körül van.
Tünetek és tünetek
A HGA klinikai lefolyása a tünetmentes fertőzéstől a halálos kimenetelű betegségig terjed. A kezdeti tünetek, amelyek körülbelül öt-tíz nappal a kullancscsípés után jelentkeznek, nagyrészt nem specifikusak: láz, hidegrázás, erős fejfájás és izomfájdalom;j hányinger, köhögés és ízületi fájdalmak is előfordulhatnak. A kiütések ritkák, de előfordultak.
A HME-hez képest a HGA kevésbé valószínű, hogy a központi idegrendszert érinti, de a perifériás neuropátiák (pl. zsibbadás és bizsergés) gyakoribbak, és hetekig-hónapokig tarthatnak. Az orvosi szakirodalomban ismertetett neurológiai leletek között szerepel az arcbénulás, a demyelinizáló polineuropátia és a brachiális plexiopátia. Légzési distressz szindrómáról és szeptikus vagy toxikus sokkszerű szindrómáról is beszámoltak, de úgy tűnik, hogy ezek kevésbé gyakoriak, mint a HME esetében. A HGA általános halálozási aránya nagyon alacsony (kevesebb mint 1%), a legtöbb halálesetet az immunhiányos betegek opportunista fertőzései (például herpes simplex nyelőcsőgyulladás, Candida-pneumonitis és tüdőaszpergillózis) okozzák.
Diagnózis
A HGA-ban végzett standard vérvizsgálatok általában a HME-ben látottakhoz hasonló leleteket mutatnak: leukopénia, trombocitopénia és májfunkciós eltérések (emelkedett transzaminázok). A hematológiai eltérések azonban gyakran a tünetek második hetére megszűnnek, így hiányukat ebben az összefüggésben kell értelmezni, ha a betegek a betegségük későbbi szakaszában jelentkeznek. Általában empirikus antibiotikus kezelést kell megfontolni az endémiás területeken élő, HGA-ra utaló akut lázas betegséggel jelentkező betegek esetében.
A specifikus diagnózis felállításához a Wright- vagy Giemsa-festésű vérkenet valamivel nagyobb eredményt ad, mint a HME, de még mindig nem optimális az általános klinikai hasznosság szempontjából, mivel úgy tűnik, hogy e tesztek érzékenysége nagy eltérést mutat (25-75%) a gazdaszervezet neutrofil sejtjeiben lévő morulák megjelenítésében. Hasznosabbak, de nem mindig állnak rendelkezésre a polimeráz láncreakció (PCR) tesztek, amelyek érzékenysége a becslések szerint 67-90%. A korábbi antibiotikus kezelés drámaian csökkenti mindkét diagnosztikai módszer érzékenységét.
A szerológiai vizsgálat hasznos az anaplazmózis diagnózisának megerősítésére. A leggyakrabban alkalmazott módszer az IgM és IgG anti-A. phagocytophilum antitestek indirekt immunfluoreszcenciája (IFA). A szerokonverzió talán a legérzékenyebb laboratóriumi bizonyíték az A. phagocytophilum-fertőzésre, de nem mindig kapják meg elég időben ahhoz, hogy a klinikai (azaz a kezelési) döntésekhez hasznos információkat szolgáltasson.