Oxygen family
Az oxigéncsalád a periódusos rendszer 16. csoportját alkotó elemekből áll: oxigén, kén, szelén, tellúr és polónium. Ezek az elemek mind hat elektronnal rendelkeznek a legkülső energiaszintjükön, ami néhány közös kémiai tulajdonságot jelent közöttük. Más tekintetben azonban az elemek meglehetősen különböznek egymástól. Az oxigén gáznemű nemfém; a kén és a szelén szilárd nemfém; a tellúr szilárd metalloid; a polónium pedig szilárd fém.
Ismertető szavak
Sav: Olyan anyagok, amelyek vízben oldva képesek reakcióba lépni egy bázissal, hogy sókat képezzenek és hidrogénionokat szabadítsanak fel.
Allotróp: Egy elem két vagy több formája közül az egyik.
Égés: Az oxidáció egy olyan formája, amely olyan gyorsan megy végbe, hogy észrevehető hő és fény keletkezik.
Repedés: Az a folyamat, amelynek során a nagy szénhidrogénmolekulák kisebb összetevőkre bomlanak.
Elektrolízis: Az a folyamat, amelynek során elektromos áram kémiai változást, általában valamilyen anyag lebomlását okozza.
Izotópok: Ugyanannak az elemnek két vagy több olyan formája, amelynek atommagjában a protonok száma megegyezik, de a neutronok száma eltérő.
Litoszféra: A Föld szilárd része, különösen a külső kéregrégió.
LOX: A folyékony oxigén rövidítése.
Metallurgia: Az a tudomány és technológia, amely a fémek ércekből való kinyerésével és gyakorlati értékkel bíró formákká alakításával foglalkozik.
Naszcens oxigén: Az oxigén olyan allotípusa, amelynek molekulái egy-egy oxigénatomot tartalmaznak.
Ózon: Az oxigén olyan allotípusa, amely molekulánként három atomból áll.
Termelőgáz: Szintetikus üzemanyag, amely elsősorban szén-monoxid és hidrogén gázokból áll.
Fehérjék: Nagy molekulák, amelyek nélkülözhetetlenek minden élő sejt szerkezetéhez és működéséhez.
Radioaktív bomlás: Az a kiszámítható mód, ahogyan egy radioaktív elem atomjainak egy populációja idővel spontán szétesik.
Oxigén
Az oxigén színtelen, szagtalan, íztelen gáz, olvadáspontja -218°C (-360°F), forráspontja -183°C (-297°F). A földkéregben a legnagyobb mennyiségben előforduló elem, súlya alapján a légkör mintegy negyedét, a litoszféra (a földkéreg) mintegy felét és a hidroszféra (az óceánok, tavak és más vízformák) mintegy 85 százalékát alkotja. Szabad elemként és sokféle vegyületben egyaránt előfordul. A légkörben elemi oxigén formájában fordul elő, amelyet néha kétatomos molekulákból, O 2 -ből álló kétatomos oxigénnek is neveznek. A vízben hidrogén-oxid, H 2 O formájában, a litoszférában pedig olyan vegyületekben fordul elő, mint az oxidok, karbonátok, szulfátok, szilikátok, foszfátok és nitrátok.
Az oxigén két allotróp formában is létezik (ugyanazon anyag fizikailag vagy kémiailag különböző formái): molekulánként egy atom (O) és molekulánként három atom (O 3 ). Az előbbi allotrópot egyatomos vagy nazális oxigénnek, az utóbbit háromatomos oxigénnek vagy ózonnak nevezik. A természetben a legtöbb esetben az oxigén kétatomos formája dominál. A sztratoszféra felső részén azonban a napenergia hatására a kétatomos forma egyatomos formává bomlik, amely aztán kétatomos molekulákkal rekombinálódva ózont képezhet. Az ózon jelenléte a Föld légkörében kritikus fontosságú a földi élet fennmaradása szempontjából, mivel ez az allotrop hajlamos elnyelni az ultraibolya sugárzást, amely egyébként káros vagy akár halálos lenne a bolygó felszínén élő növények és állatok számára egyaránt.
Az oxigént egymástól függetlenül Carl Scheele svéd kémikus (1742-1786) és Joseph Priestley angol kémikus (1733-1804) fedezte fel az 1773 és 1774 közötti időszakban. Az elemnek az 1770-es évek végén Antoine Laurent Lavoisier (1743-1794) francia kémikus adta a nevét. Neve a francia “savképző” szóból származik, ami Lavoisier téves meggyőződését tükrözi, miszerint minden sav oxigént tartalmaz.
Előállítás. Az oxigén kereskedelmi célú előállításának messze legelterjedtebb módja a folyékony levegő frakcionált desztillációja. A levegőmintát először nagyon alacsony, -200°C (-330°F) körüli hőmérsékletre hűtik. Ezen a hőmérsékleten a levegőt alkotó gázok többsége folyékony halmazállapotúvá válik. A folyékony levegőt ezután hagyják elpárologni. Körülbelül -196°C (-320°F) hőmérsékleten a nitrogén elkezd elforrni. Amikor a nitrogén nagy része eltűnik, az argon és a neon is kiforr, és az oxigén egy tisztátalan formája marad vissza. Az oxigén azért tisztátalan, mert kis mennyiségű kripton, xenon és más gázok maradhatnak a folyékony formában. Az oxigén további tisztítása érdekében a hűtés, a cseppfolyósítás és az elpárolgás folyamata megismételhető.
Az oxigént általában folyékony formában tárolják és szállítják, ezt a formát LOX (a l iquid ox ygen) néven is ismerik. A LOX-tartályok úgy néznek ki, mint a nagyon nagy vákuumos palackok, amelyek egy duplafalú tartályból állnak, a falak között vákuummal. Az elem kevésbé könnyen tárolható és szállítható gáz halmazállapotban is, körülbelül 1,2 méter (4 láb) magas és 23 centiméter (9 hüvelyk) átmérőjű acélfalú tartályokban. Sok esetben az oxigént a felhasználás helyén állítják elő. A korábban ismertetett frakcionált desztillációs eljárás kellően egyszerű és olcsó ahhoz, hogy sok iparág saját oxigéngyártó létesítményt tudjon biztosítani.
Felhasználások. Az oxigénnek olyan sok kereskedelmi, ipari és egyéb felhasználási módja van, hogy az Egyesült Államokban gyártott mennyiségét tekintve folyamatosan az első öt vegyi anyag között van. Az Egyesült Államokban 1990-ben például mintegy 18 milliárd kilogrammot (39 milliárd fontot) állítottak elő ebből az elemből.
Az oxigén felhasználása négy fő kategóriába sorolható: kohászat, rakétatechnika, kémiai szintézis és orvostudomány. A vasérc nagyolvasztóban történő feldolgozása során például az oxigént a koksz (szén) szén-monoxiddá történő átalakítására használják. A szén-monoxid viszont a vasoxidokat tiszta vasfémné redukálja. Az oxigént ezután a vasfeldolgozás második lépésében, a Bessemer-konverterben, a nyitott kemencében vagy a “nyersvas” acéllá történő átalakításának oxigénes alapfolyamatában használják. Ebben a lépésben az oxigént arra használják, hogy reakcióba lépjen a nyersvasban maradt felesleges szénnel, szilíciummal és fémekkel, amelyeket az acél előállításához el kell távolítani.
Az oxigén másik kohászati alkalmazása a hegesztéshez és vágáshoz használt fáklyákban található. A két legelterjedtebb fáklya az oxigén és a hidrogén (oxihidrogén fáklya) vagy az oxigén és az acetilén (oxi-acetilén fáklya) közötti reakciót használja. Mindkét típusú fáklya legalább 3000 °C-os (5 400 °F) hőmérsékletet produkál, és ezért a fémanyagok nagy többségének átvágására vagy hegesztésére használható.
LOX formájában az oxigént széles körben használják oxidálószerként sokféle rakétában és rakétában. Például az űrsikló űrbe emeléséhez szükséges hatalmas külső üzemanyagtartály 550 000 liter folyékony oxigént és 1 500 000 liter folyékony hidrogént tartalmaz. Amikor ez a két elem reakcióba lép az űrsikló főhajtóműveiben, 512 000 font maximális tolóerőt biztosítanak.
A vegyipar évente hatalmas mennyiségű oxigént használ fel a különböző kémiai szintézis (képződési) reakciók során. Ezek közül az egyik legfontosabb a szénhidrogének oxigénnel történő krakkolása. A legtöbb esetben a szénhidrogén oxigénnel történő hevítése égést eredményez, amelynek fő termékei szén-dioxid és víz. Ha azonban gondosan szabályozzuk az oxigén adagolásának sebességét a szénhidrogén-keverékbe, akkor a szénhidrogén “megreped,” vagy más termékek, például acetilén, etilén és propilén keletkeznek belőle.
Különböző típusú szintetikus üzemanyagok is előállíthatók úgy, hogy az oxigén az egyik fő reaktáns. A termelőgázt például úgy állítják elő, hogy oxigént szabályozott sebességgel vezetnek át forró szén- vagy kokszágyon. A reakció során keletkező szén-dioxid nagy része szén-monoxiddá redukálódik, így a végtermék (a termelőgáz) elsősorban szén-monoxidból és hidrogénből áll.
Az oxigén talán legismertebb orvosi alkalmazása az oxigénterápia, ahol a légzési nehézségekkel küzdő betegeknek tiszta vagy csaknem tiszta oxigént adagolnak. Az oxigénterápiát gyakran alkalmazzák sebészeti beavatkozások során, szüléskor, szívinfarktusból való felépüléskor és fertőző betegségek kezelése során. A tiszta oxigén biztosítása minden esetben csökkenti a szív és a tüdő terhelését, felgyorsítva a gyógyulás ütemét.
Tiszta oxigén vagy oxigénnel dúsított levegő olyan környezetben is biztosítható, ahol a légzés nehézkes lehet. A nagy magasságban repülő repülőgépeket természetesen mindig ellátják oxigénkészlettel arra az esetre, ha a hajó normál levegőellátásával bármilyen probléma adódna. A mélytengeri búvárok szintén oxigénnel dúsított levegőt szállítanak magukkal vagy szivattyúznak magukhoz.
Egyes víztisztító és szennyvíztisztító üzemek oxigént használnak. A gázt a vízbe szivattyúzzák, hogy növeljék azt a sebességet, amellyel a természetben előforduló baktériumok lebontják a szerves hulladékanyagokat. Kiderült, hogy egy hasonló folyamat csökkenti a tavak és tavak eutrofizálódásának sebességét, sőt, egyes esetekben meg is fordítja ezt a folyamatot. (Az eutrofizáció a tápanyagok feloldódása egy víztestben. A vízi növényzet növekedése és az oldott oxigén csökkenése a folyamat két fő eredménye).
Végül pedig az oxigén nélkülözhetetlen a földi állatvilág számára. Az ember néhány napot vagy hetet túlélhet víz vagy táplálék nélkül, de legfeljebb néhány percet oxigén nélkül. Oxigén hiányában a sejtekben zajló energiatermelő kémiai reakciók leállnának, és az ember meghalna.
Kén
A kén egy nem fémes elem, amely számos allotróp formában (ugyanazon anyag fizikailag vagy kémiailag különböző formái) létezhet. A legismertebbeket rombikus és monoklin kénnek nevezik. Mindkettő élénksárga szilárd anyag, olvadáspontjuk körülbelül 115 °C (239 °F). A harmadik formát plasztikus vagy amorf kénnek nevezik. Ez egy barnás színű folyadék, amely a rombikus vagy monoklin kén megolvasztásakor keletkezik.
Magának a kénnek egyáltalán nincs szaga. Ebből a szempontból azonban rossz híre van, mert néhány leggyakoribb vegyületének erős szaga van. A kén-dioxid, az egyik ilyen vegyület, éles, fojtogató, fullasztó hatással van arra, aki belélegzi. A bibliai “tűz és kénkő” az egyik legrosszabb büntetés volt, amit a szerzők el tudtak képzelni. A kénkő ebben a kifejezésben az égő kénre, vagyis a kén-dioxidra utalt. Az a tény, hogy a kén mélyen a föld alól származik, és hogy a kén-dioxidot a vulkánok füstjében lehet érezni, tovább táplálta az emberek képzeletét arról, hogy milyen lehet a pokol.
Egy másik rossz szagú kénvegyület a hidrogén-szulfid. A záptojás erős szaga ennek a vegyületnek a jelenlétére vezethető vissza.
Előfordulás és előállítás. A kén a tizenhatodik leggyakoribb elem a földkéregben. Elemként és különféle vegyületekben egyaránt előfordul. Elemként nagyon nagy, földalatti bányákban található, leggyakrabban az Egyesült Államok Öböl-menti partvidékén, valamint Lengyelországban és Szicíliában. A ként ezekből a bányákból a Frasch-eljárás segítségével nyerik ki. Ebben az eljárásban túlhevített gőzt pumpálnak át egy három csőből álló sorozat legkülső részén. A legbelső csőben sűrített levegőt nyomnak le. A túlhevített gőz hatására a föld alatti kén megolvad, a sűrített levegő pedig a három cső közepén keresztül felfelé, a földfelszínre kényszeríti.
A kén ásványok és ércek formájában is széles körben elterjedt. Ezek közül sok szulfátok formájában van jelen, köztük a gipsz (kalcium-szulfát, CaSO 4 ), a barit (bárium-szulfát, BaSO 4 ) és az Epsom-sók (magnézium-szulfát, MgSO 4 ). Mások fémszulfidok, köztük a vaspirit (vasszulfid, FeS 2 ), a galenit (ólomszulfid, PbS), a cinóber (higanyszulfid, HgS), a szibnit (antimonszulfid, Sb 2 S 3 ) és a cinkblende (cinkszulfid, ZnS). A ként úgy nyerik ki ezekből a fémércekből, hogy levegőn erősen hevítik őket, ami a ként kén-dioxiddá alakítja, és felszabadítja a tiszta fémet. Ezután a kén-dioxid közvetlenül a kénsavgyártásba kerülhet, ahová a világ bányászott kénjének több mint 90 százaléka kerül.
A kén és vegyületeinek felhasználása. A kén egy részét közvetlenül gomba- és rovarölőszerként, gyufában, tűzijátékokban és lőporban, valamint a természetes gumi vulkanizálásában (a gumi rugalmasságát és szilárdságát biztosító kezelés) használják fel. A legtöbbet azonban számos hasznos vegyületté alakítják át.
A kénvegyületek közül messze a legfontosabb a kénsav. Az összes termelt kén közel 90 százaléka először kén-dioxiddá, majd kénsavvá alakul át. A sav következetesen az első helyen áll az Egyesült Államokban előállított vegyi anyagok között. 1990-ben több mint 40 milliárd kilogramm (89 milliárd font) kénsavat állítottak elő, több mint 50 százalékkal többet, mint a második legnépszerűbb vegyi anyagot (nitrogéngáz). A kénsavat műtrágyák, autóakkumulátorok, kőolajtermékek, pigmentek, vas és acél, valamint számos más termék előállításához használják.
A kén körforgása. A nitrogénhez, a szénhez és a foszforhoz hasonlóan a kén is áthalad bolygónk gáznemű, folyékony és szilárd részein a kén körforgása néven ismert folyamatos reakciók sorozatában. A kén körforgásának főbb lépéseit a mellékelt ábra szemlélteti.
A kén a természetben vulkánkitörések és a forró forrásokból származó kibocsátások eredményeként keletkezik. Elsősorban kén-dioxid formájában kerül a légkörbe, majd ebben a formában, illetve vízzel való reakcióját követően kénsav formájában marad a légkörben. A kén savas lerakódás formájában visszakerül a Föld felszínére, amikor esik az eső vagy havazik.
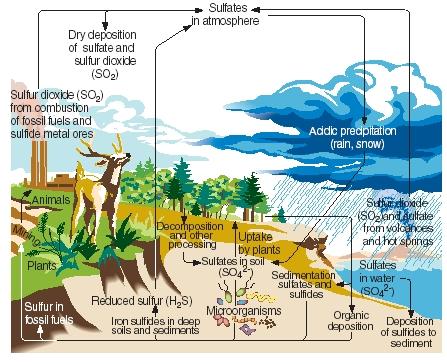
engedélyével.)
A Föld felszínén a kén-dioxid és a kénsav fémekkel reagálva szulfátokat és szulfidokat képez. Az elemet a növények is beépítik szerves kén néven ismert formában. Bizonyos aminosavak, a fehérjéket alkotó vegyületek ként tartalmaznak. A növényekből származó szerves kén végül átadódik a növényeket fogyasztó állatoknak. A növényi fehérjékből viszont állati fehérjékké alakul át.
Amikor a növények és állatok elpusztulnak, a kén visszakerül a talajba, ahol a mikroorganizmusok kénhidrogénné alakítják át. A kénhidrogéngáz ezután visszakerül a légkörbe, ahol kénsavvá oxidálódik.
Az emberi tevékenységek számos módon befolyásolják a kén körforgását. Például a szén és a fémércek bányászata során kén és szulfidok szabadulhatnak fel és kerülhetnek vissza a talajba. Emellett a szén, a kőolaj és a földgáz elégetése során gyakran kén-dioxid kerül a légkörbe. Ez a kén-dioxid hozzáadódik a természetes forrásokból már jelen lévő mennyiséghez, nagymértékben megnövelve a Föld felszínére hulló savas csapadék mennyiségét. Egyesek úgy vélik, hogy a savas csapadék (vagy savas eső) felelős a fák és más növények pusztulásáért, a tavak savasodásáért, amely károsította a tengeri állatokat, a fém- és kőszerkezetek károsodásáért és más környezeti károkért.
Szelén, tellúr és polónium
A szelén és a tellúr is viszonylag ritka elem. Bőségüket tekintve az összes elem alsó tíz százalékába tartoznak. A földkéregben általában réz- és más fémek érceivel együtt fordulnak elő. Mindkettőt a réz elektrolitikus finomításának melléktermékeként nyerik. A folyamat során az elektrolízistartály aljára süllyednek, ahol a keletkező iszapból eltávolíthatók.
A szelén többféle allotróp formában fordul elő (ugyanazon anyag fizikailag vagy kémiailag különböző formái), amelyek közül a leggyakoribb egy vörös por, amely levegővel érintkezve feketévé válik. Az elem olvadáspontja 217 °C (423 °F), forráspontja 685 °C (1 265 °F). A tellúr ezüstfehér szilárd anyag, amely úgy néz ki, mint egy fém (bár valójában metalloid). Olvadáspontja 450°C (842°F), forráspontja 990°C (1,814°F).
A szelénnek érdekes szerepe van az élő szervezetekben. Nagyon alacsony koncentrációban a legtöbb állat esetében nélkülözhetetlen az egészség megőrzéséhez. Valójában gyakran adják hozzá az állati takarmányokhoz. Nagyobb koncentrációban azonban az elemről kiderült, hogy káros hatással van az állatokra, deformált kicsinyeket és beteg felnőtteket okozva.
A szelént elsősorban az elektronikában és a színes üveg gyártásában használják fel. A fénymásoló gépek, a napelemek, a fotocellák, a televíziós képcsövek, valamint az elektronikus egyenirányítók és relék (amelyek az elektromos áram áramlásának szabályozására szolgálnak) mind szelént használnak. A legszebb színes üvegek némelyike – a halvány rózsaszíntől a ragyogó vörösig – szelénvegyületekből készül.
Kis mennyiségű tellúrt is használnak a színes üvegek előállításához. Az elem több mint 90 százaléka azonban vas és más fémek ötvözeteinek előállítására megy el.
A polóniumnak 27 izotópja van, amelyek mindegyike radioaktív. A természetben az uránércekben fordul elő, ahol az urán radioaktív bomlásának hosszú reakciósorozatának végterméke. Az egyik legritkább elem a Földön, előfordulása nem több, mint körülbelül 3 × 10-10-10 milliomodrész. A polónium felfedezése 1898-ban Marie Curie (1867-1934) lengyel-francia kémikus által a tudománytörténet egyik legdrámaibb története. Több tonna uránércet dolgozott fel, hogy néhány milligrammnyi új elemet nyerjen, amelyet aztán hazájáról, Lengyelországról nevezett el. A polóniumot korlátozottan használják a magasan specializált energiatermelő berendezésekben, például az űrszatellitek és űrszondák esetében.