19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- „R” group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Każdy aminokwas różni się pod względem grupy „R”. Grupa „R” aminokwasu to reszta cząsteczki, czyli część inna niż grupa aminowa, grupa kwasowa i węgiel centralny. Każdy inny aminokwas ma unikalną grupę „R”, a unikalne właściwości chemiczne aminokwasu zależą od jego grupy „R” (Rysunek).
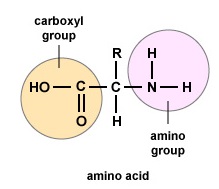
Aminokwasy, tworząc polipeptydy i białka, łączą się ze sobą za pomocą wiązań peptydowych, w których aminokwas lub NH2 jednego aminokwasu łączy się z grupą karboksylową (kwasową) lub COOH innego aminokwasu, jak pokazano na (rysunek \(\PageIndex{2}}) i rysunek \(\PageIndex{3}}).
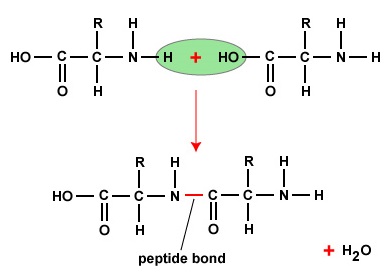
Peptyd to dwa lub więcej aminokwasów połączonych ze sobą wiązaniami peptydowymi, a polipeptyd to łańcuch wielu aminokwasów. Białko zawiera jeden lub więcej polipeptydów. Dlatego białka są długimi łańcuchami aminokwasów połączonych wiązaniami peptydowymi.
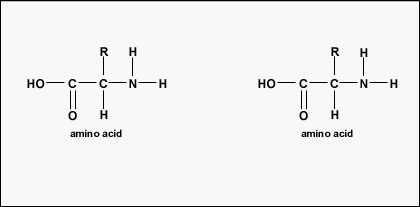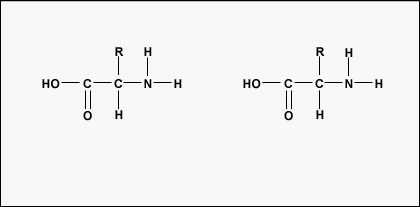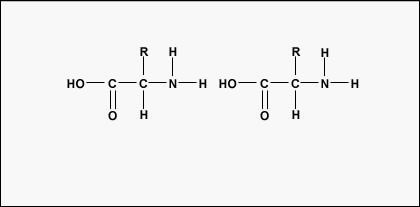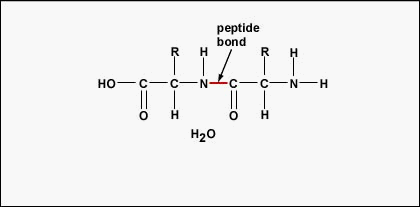
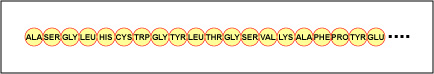
Faktyczna kolejność aminokwasów w białku nazywana jest jego strukturą podstawową (Rysunek \(\PageIndex{4}}) i jest określana przez DNA. Jak zobaczymy w dalszej części tego rozdziału, DNA jest podzielone na funkcjonalne jednostki zwane genami. Gen jest sekwencją zasad deoksyrybonukleotydowych wzdłuż jednej nici DNA, która koduje produkt funkcjonalny – specyficzną cząsteczkę RNA posłańca, transferowego RNA lub rybosomalnego RNA. Produktem tym jest zwykle posłańczy RNA (mRNA), a mRNA ostatecznie prowadzi do syntezy polipeptydu lub białka. Dlatego powszechnie mówi się, że kolejność zasad dezoksyrybonukleotydowych w genie determinuje sekwencję aminokwasów danego białka. Ponieważ niektóre aminokwasy mogą oddziaływać z innymi aminokwasami w tym samym białku, ta pierwotna struktura ostatecznie określa ostateczny kształt, a zatem właściwości chemiczne i fizyczne białka.
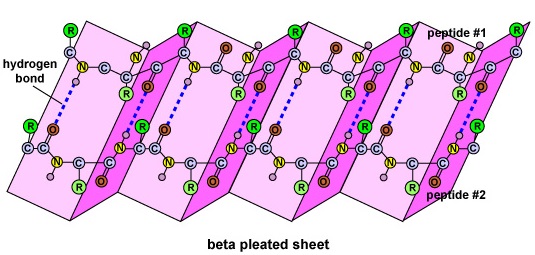
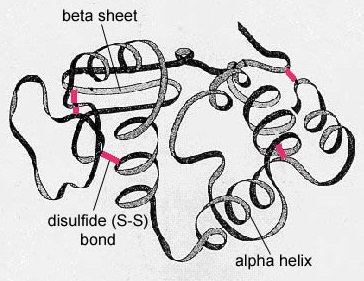
Struktura wtórna białka wynika z wiązań wodorowych, które tworzą się między atomem tlenu jednego aminokwasu a atomem azotu innego. Nadaje to białku lub polipeptydowi dwuwymiarową postać alfa-helisy lub beta-plecionej wstęgi (Rysunek \(\)).
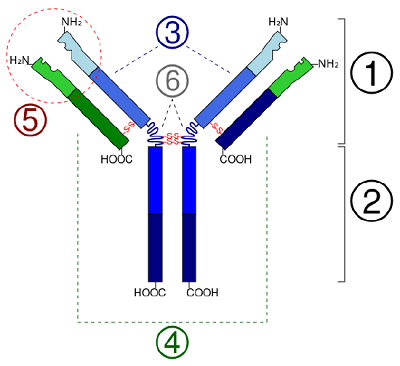
W białkach globularnych, takich jak enzymy, długi łańcuch aminokwasów zostaje złożony w trójwymiarowy kształt funkcjonalny lub strukturę trzeciorzędową. Dzieje się tak dlatego, że niektóre aminokwasy z grupami sulfhydrylowymi lub SH tworzą wiązania disulfidowe (S-S) z innymi aminokwasami w tym samym łańcuchu. Inne oddziaływania pomiędzy grupami R aminokwasów, takie jak wiązania wodorowe, wiązania jonowe, wiązania kowalencyjne i oddziaływania hydrofobowe, również przyczyniają się do powstania struktury trzeciorzędowej (rysunek). W niektórych białkach, takich jak cząsteczki przeciwciał i hemoglobina, kilka polipeptydów może łączyć się ze sobą, tworząc strukturę czwartorzędową (Rysunek ®(\PageIndex{7}}).
Jak zobaczymy w dalszej części tej jednostki, podczas syntezy białek, kolejność zasad nukleotydowych wzdłuż genu zostaje przepisana na komplementarną nić mRNA, która jest następnie tłumaczona przez tRNA na prawidłową kolejność aminokwasów dla danego polipeptydu lub białka. Dlatego też kolejność zasad dezoksyrybonukleotydowych w DNA określa kolejność aminokwasów w białkach. Ponieważ niektóre aminokwasy mogą oddziaływać z innymi aminokwasami, kolejność aminokwasów w każdym białku określa jego ostateczny trójwymiarowy kształt, który z kolei określa funkcję tego białka (np, z jakim substratem zareaguje enzym, z jakimi epitopami połączy się Fab przeciwciała, z jakimi receptorami zwiąże się cytokina).
Podsumowanie
- Aminokwasy są budulcem białek. Istnieje 20 różnych aminokwasów powszechnie występujących w białkach i często 300 lub więcej aminokwasów w cząsteczce białka.
- Wszystkie aminokwasy zawierają grupę aminową lub NH2 i grupę karboksylową (kwasową) lub COOH.
- Aby utworzyć polipeptydy i białka, aminokwasy są połączone ze sobą za pomocą wiązań peptydowych, w których grupa aminowa lub NH2 jednego aminokwasu łączy się z grupą karboksylową (kwasową) lub COOH innego aminokwasu.
- Peptyd to dwa lub więcej aminokwasów połączonych ze sobą wiązaniami peptydowymi; polipeptyd to łańcuch wielu aminokwasów; a białko zawiera jeden lub więcej polipeptydów. Dlatego, białka są długie łańcuchy aminokwasów trzymane razem przez wiązania peptydowe.
- Faktyczna kolejność aminokwasów w białku nazywa się jego struktury pierwotnej i jest określona przez DNA.
- Porządek zasad deoksyrybonukleotydów w genie określa sekwencję aminokwasów danego białka. Ponieważ niektóre aminokwasy mogą oddziaływać z innymi aminokwasami w tym samym białku, ta pierwotna struktura ostatecznie określa ostateczny kształt, a zatem właściwości chemiczne i fizyczne białka.
- Wtórna struktura białka jest ze względu na wiązania wodorowe, które tworzą się między atomem tlenu jednego aminokwasu i atomem azotu innego i daje białko lub polipeptyd dwuwymiarową formę alfa-helisy lub arkusza beta-pleated.
- W globularnych białek, takich jak enzymy, długi łańcuch aminokwasów staje się składane do trójwymiarowego kształtu funkcjonalnego lub struktury trzeciorzędowej. Dzieje się tak dlatego, że niektóre aminokwasy z grupami sulfhydrylowymi lub SH tworzą wiązania disulfidowe (S-S) z innymi aminokwasami w tym samym łańcuchu. Inne interakcje między grupami R aminokwasów, takie jak wiązania wodorowe, wiązania jonowe, wiązania kowalencyjne i interakcje hydrofobowe, również przyczyniają się do struktury trzeciorzędowej.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)