2.3: Families and Periods of the Periodic Table
Families of the Periodic Table
Pamiętaj, że Mendeleev ułożył układ okresowy tak, że pierwiastki o najbardziej podobnych właściwościach zostały umieszczone w tej samej grupie. Grupa to pionowa kolumna układu okresowego. Wszystkie pierwiastki 1A posiadają jeden elektron walencyjny. To właśnie powoduje, że pierwiastki te reagują w ten sam sposób, co inni członkowie rodziny. Wszystkie pierwiastki z grupy 1A są bardzo reaktywne i tworzą z innymi pierwiastkami związki w takich samych proporcjach o podobnych właściwościach. Ze względu na podobieństwo ich właściwości chemicznych Mendelejew zaliczył te pierwiastki do jednej grupy. Grupa 1A jest również znana jako metale alkaliczne. Chociaż większość metali ma tendencję do bycia bardzo twardymi, te metale są w rzeczywistości miękkie i mogą być łatwo cięte.
Grupa 2A jest również nazywana metalami ziem alkalicznych. Po raz kolejny, ze względu na podobieństwa w konfiguracjach elektronowych, elementy te mają podobne właściwości do siebie. Ten sam wzór jest prawdziwy dla innych grup w układzie okresowym. Pamiętaj, że Mendelejew ułożył tablicę tak, aby pierwiastki o najbardziej podobnych właściwościach znajdowały się w tej samej grupie układu okresowego.
Ważne jest, aby rozpoznać kilka innych ważnych grup w układzie okresowym po ich nazwie grupy. Grupa 7A (lub 17) pierwiastków jest również nazywana halogenami. Grupa ta zawiera bardzo reaktywne pierwiastki niemetaliczne.
Gazy szlachetne znajdują się w grupie 8A. Elementy te mają również podobne właściwości do siebie, najbardziej znaczącą właściwością jest to, że są one bardzo niereaktywne, rzadko tworząc związki. Przyczynę tego poznamy później, gdy omówimy, jak tworzą się związki. Pierwiastki z tej grupy są również gazami w temperaturze pokojowej.
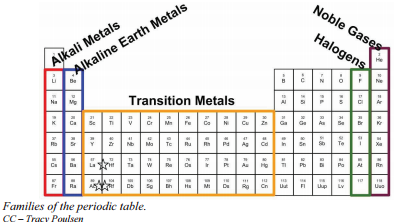
Alternatywny system numeracji numeruje wszystkie pierwiastki blokowe od 1-18. W tym systemie numeracji grupa 1A to grupa 1; grupa 2A to grupa 2; chlorowce (7A) to grupa 17; a gazy szlachetne (8A) to grupa 18. Można spotkać układy okresowe z obydwoma systemami numeracji. Ważne jest, aby rozpoznać, który system numeracji jest używany i być w stanie znaleźć liczbę elektronów walencyjnych w głównych elementach bloku niezależnie od tego, który system numeracji jest używany.