4. Mocne i Słabe Zasady
Słabe Zasady
Amoniak jest typową słabą zasadą. Amoniak sam w sobie oczywiście nie zawiera jonów wodorotlenkowych, ale reaguje z wodą wytwarzając jony amonowe i jony wodorotlenkowe.
Jednakże reakcja jest odwracalna i w każdym momencie około 99% amoniaku jest nadal obecne jako cząsteczki amoniaku. Tylko około 1% wytworzyło jony wodorotlenkowe. Słaba zasada to taka, która nie przekształca się w pełni w jony wodorotlenkowe w roztworze. Kiedy słaba zasada reaguje z wodą, pozycja równowagi zmienia się w zależności od zasady. Im dalej po lewej stronie, tym słabsza zasada.
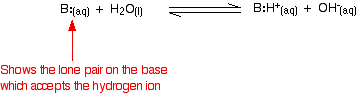
Można uzyskać miarę położenia równowagi, pisząc stałą równowagi dla reakcji. Im niższa wartość stałej, tym bardziej równowaga leży po lewej stronie. W tym przypadku stała równowagi nazywana jest Kb. Definiuje się ją jako:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other „p” terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |