Adipocyty
Adipocyty są głównymi miejscami magazynowania energii w organizmie, a także pełnią krytyczne funkcje endokrynne. Dlatego zrozumienie rozwoju i funkcji adipocytów – szczególnie w świetle pandemii otyłości – jest niezbędne do zrozumienia homeostazy metabolicznej. Istnieją dwie ogólne klasy adipocytów: adipocyty białe – które magazynują energię w postaci pojedynczej dużej kropli lipidowej i pełnią ważne funkcje endokrynne oraz adipocyty brązowe – które magazynują energię w wielu małych kroplach lipidowych, ale specjalnie do wykorzystania jako paliwo do wytwarzania ciepła w organizmie (tj. termogenezy). Produkcja ciepła przez brązowe adipocyty jest możliwa dzięki ich unikalnej ekspresji zlokalizowanego w mitochondrium białka rozprzęgającego 1 (Ucp1). Jednak te klasyfikacje są zbyt uproszczone, ponieważ niektóre białe adipocyty mogą przyjmować cechy brązowych adipocytów (określane jako brite lub beżowe adipocyty) i odwrotnie, w zależności od temperatury i diety. Jesteśmy zainteresowani zrozumieniem pochodzenia różnych adipocytów oraz określeniem szlaków sygnalizacyjnych i metabolicznych, które kontrolują ich rozwój, dystrybucję i funkcjonowanie.
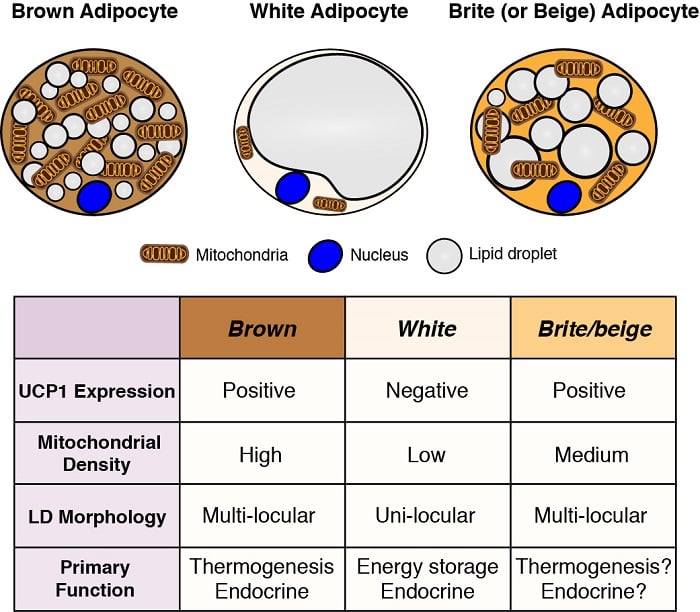
Pochodzenie adipocytów
Kluczowym dla zrozumienia roli tkanki tłuszczowej w zdrowiu i chorobie jest zrozumienie, jak ona rośnie, i pod tym względem jednym z najmniej poznanych obszarów biologii tkanki tłuszczowej jest pochodzenie rozwojowe różnych typów adipocytów. Zdefiniowanie pochodzenia adipocytów może pomóc w wyjaśnieniu wzorców dystrybucji tłuszczu w organizmie człowieka, szczególnie u osób otyłych lub z lipodystrofią, a także może dostarczyć wskazówek na temat różnic metabolicznych obserwowanych pomiędzy niektórymi depozytami tłuszczu. Identyfikacja komórek prekursorowych adipocytów i mechanizmów regulujących ich ekspansję jest również kluczowa dla zrozumienia i zarządzania zdrową funkcją tkanki tłuszczowej. Możliwe jest również zaprojektowanie rozwoju „zdrowych” adipocytów (takich jak brązowe lub brunatne/beżowe adipocyty) z prekursorów dla terapii opartych na komórkach, których celem jest walka z tłuszczem za pomocą tłuszczu. Używając kombinacji genetyki i strategii śledzenia linii rozwojowych, wcześniej zmapowaliśmy pochodzenie adipocytów rezydujących w różnych depot. Nasze wyniki ujawniają nieoczekiwany poziom heterogeniczności zgodny z tym, że adipocyty mają wiele początków rozwojowych i wspierają model, w którym los adipocytów prawdopodobnie zależy zarówno od czynników zewnętrznych, jak i wewnętrznych.
Adipocyty mają wiele początków rozwojowych
(poniżej po lewej) Anatomiczne rozmieszczenie magazynów tkanki tłuszczowej u myszy. Pokazano brązową tkankę tłuszczową (BAT) i białą tkankę tłuszczową (WAT). (poniżej po prawej) Przykład eksperymentu śledzenia linii, podczas którego rozwojowe komórki prekursorowe i wszystkie ich komórki potomne były trwale znakowane fluorescencyjnym znacznikiem związanym z ekspresją Myf5 (panel a) lub Pax3 (panel b). Adipocyty znakowane na zielono (mGFP) pochodzą z innej komórki prekursorowej niż adipocyty znakowane na czerwono (mTFP).
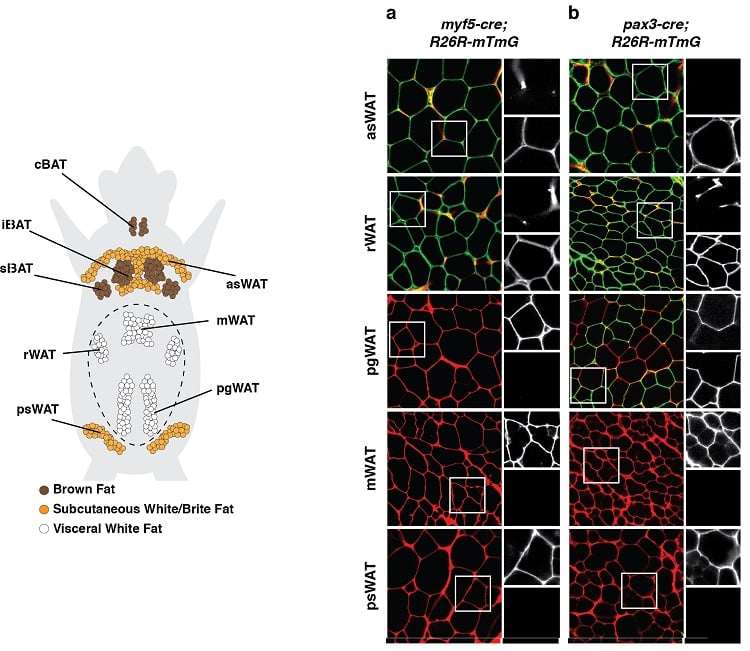
Wyniki takie jak te sugerują, że adipocyty mają wiele początków rozwojowych.
(zaadaptowano z Sanchez-Gurmaches & Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016)
Brązowe adipocyty
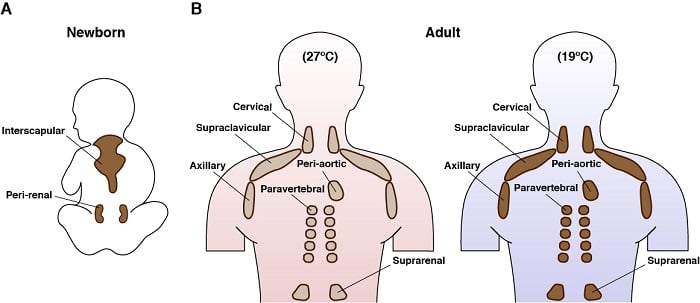
Brązowe adipocyty to fascynujące komórki. Występują tylko u ssaków, a ich główną funkcją jest generowanie endogennego ciepła w procesie zwanym termogenezą. Jest to możliwe dzięki unikalnej ekspresji mitochondrialnego białka błonowego zwanego białkiem rozprzęgającym 1 (UCP1). Właściwości wydatkowania energii przez brunatną tkankę tłuszczową oraz niedawna świadomość, że dorośli ludzie posiadają brunatną tkankę tłuszczową, sprawiły, że stała się ona celem terapii mających na celu walkę z nadmiernym odżywianiem. Aktywne brązowe adipocyty mają również jeden z najbardziej intrygujących programów metabolicznych: pobierają i konsumują jednocześnie duże ilości różnych składników odżywczych (np. glukozy, lipidów, aminokwasów) i mogą jednocześnie angażować się w metabolizm zarówno anaboliczny jak i kataboliczny. Na przykład, my i inni wcześniej wykazaliśmy, że stymulowane zimnem BAT szeroko regulują program genetyczny, który wspiera szlaki syntezy lipidów de novo oprócz szlaków utleniania kwasów tłuszczowych. Chcielibyśmy dowiedzieć się więcej na temat tego niezwykłego i paradoksalnego metabolizmu.
Dowiedz się więcej o rozwoju i metabolizmie brunatnej tkanki tłuszczowej
Anatomiczna lokalizacja brunatnej tkanki tłuszczowej u ludzi
Używamy również modeli genetycznych do badania, jak szlaki sygnalizacyjne kontrolują metabolizm BAT. Na przykład u myszy genetycznie usunęliśmy Rictor, który koduje unikalny i niezbędny składnik mTORC2, tylko w brązowej tkance tłuszczowej. Dowiedz się więcej o mTORC2. Co zadziwiające, myszy te są chronione przed dietą wysokotłuszczową. Dokładniej mówiąc, myszy pozbawione BAT Rictor nie gromadziły nadmiernej ilości lipidów w wątrobie lub trzewnej tkance tłuszczowej podczas spożywania diety wysokotłuszczowej. Jest to ekscytujące odkrycie, ponieważ nadmierne magazynowanie lipidów w tych miejscach jest niebezpiecznie niezdrowe. Używając kombinacji genetyki, genomiki, metabolomiki i biochemii, próbujemy zrozumieć, dlaczego te myszy są chronione przed dietą wysokotłuszczową.
Białe adipocyty
Białe adipocyty są najbardziej obficie występującymi adipocytami u ludzi. Depozyty białej tkanki tłuszczowej mają również niezwykłą zdolność do rozszerzania się i przechowywania energii, a także sygnalizują mózgowi i innym tkankom, aby silnie wpływać na zachowania żywieniowe i homeostazę metaboliczną. Jednakże, podczas gdy białe adipocyty są specjalnie przystosowane do bezpiecznego przechowywania nadmiaru składników odżywczych, mają one punkt krytyczny (np. w otyłości), w którym ich korzystne funkcje zawodzą, a to silnie promuje pojawienie się choroby metabolicznej i cukrzycy typu 2. Co definiuje ten punkt krytyczny? W jaki sposób białe adipocyty wysyłają sygnały do innych tkanek? Jak bardzo heterogeniczne są depozyty białej tkanki tłuszczowej? Dlaczego nadmiar trzewnej tkanki tłuszczowej jest bardziej szkodliwy dla zdrowia niż nadmiar podskórnej tkanki tłuszczowej? To wszystko są pytania, które nas interesują.
Badamy również sygnalizację mTOR w białych adipocytach. mTOR jest głównym celem sygnalizacji insulinowej, która jest głównym hormonem, na który reagują adipocyty. Używając genetycznych modeli myszy, selektywnie hamowaliśmy albo mTORC1 albo mTORC2 we wszystkich adipocytach. Zahamowanie mTORC1 w białej tkance tłuszczowej powoduje zespół podobny do lipodystrofii, związany z insulinoopornością i stłuszczeniem wątroby. Zahamowanie mTORC2 w białej tkance tłuszczowej również powoduje insulinooporność, ale niezależnie od zmian w masie tkanki tłuszczowej. W tym ostatnim modelu, mTORC2 wydaje się regulować sygnał pochodzący z adipocytów, który komunikuje się z wątrobą w celu kontrolowania wątrobowej produkcji glukozy. Zrozumienie mechanistycznych podstaw tych fenotypów dostarczy krytycznych informacji o tym, jak szlaki transdukcji sygnału wyczuwające składniki odżywcze przyczyniają się do patogenezy chorób związanych z tkanką tłuszczową.
Model sygnalizacji mTORC2 w białym adipocycie
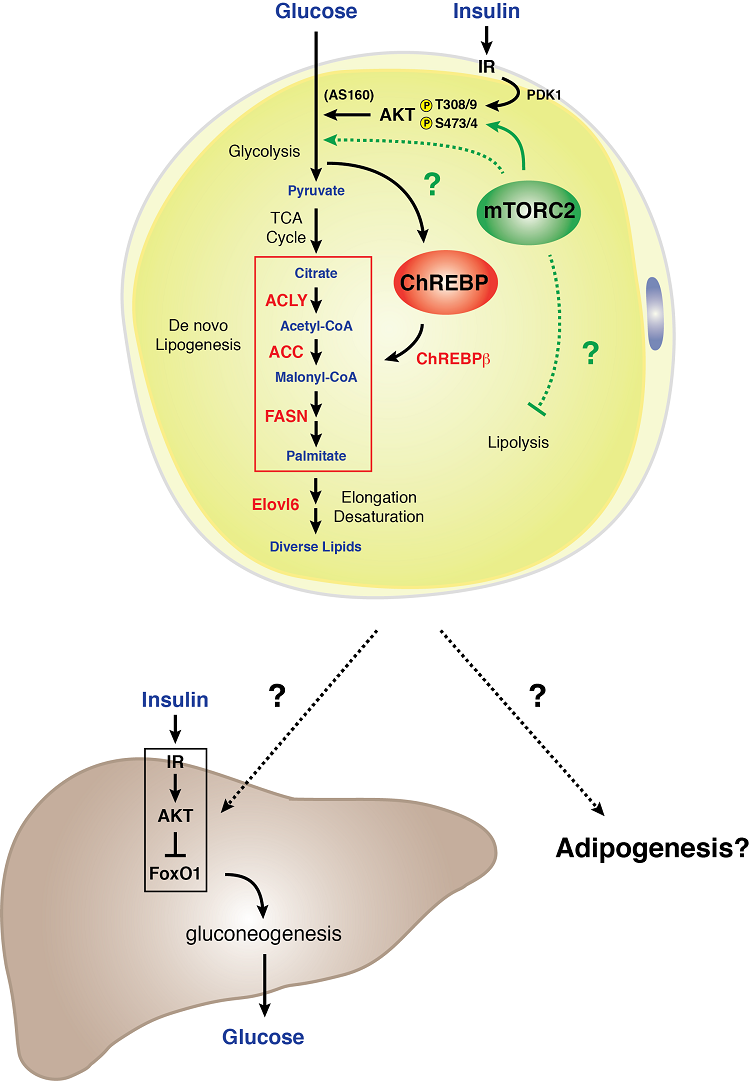 Białe adipocyty wymagają mTORC2 do normalnego metabolizmu węglowodanów i lipidów. Stwierdziliśmy, że genetyczna utrata Rictor (mTORC2) specyficznie w białych adipocytach zmniejsza wychwyt glukozy i osłabia ekspresję czynnika transkrypcyjnego ChREBP-beta i jego celów downstream – co obejmuje enzymy, które działają w ścieżce lipogenezy de novo. Ponadto, niedobór mTORC2 w białych komórkach tłuszczowych skutkuje ciężką wątrobową insulinoopornością. Dane te wskazują, że mTORC2 w białych adipocytach jest istotnym regulatorem metabolizmu węglowodanów i lipidów i jest kluczowym elementem pozawątrobowego mechanizmu komunikacji narządów wyczuwających składniki odżywcze, który kontroluje ogólnoustrojową homeostazę glukozy. Zrozumienie biologii sygnalizacji mTORC2 w tłuszczu białym może zawierać ważne wskazówki, jak biała tkanka tłuszczowa funkcjonuje jako organ wyczuwający glukozę i mediator ogólnoustrojowej sprawności metabolicznej.
Białe adipocyty wymagają mTORC2 do normalnego metabolizmu węglowodanów i lipidów. Stwierdziliśmy, że genetyczna utrata Rictor (mTORC2) specyficznie w białych adipocytach zmniejsza wychwyt glukozy i osłabia ekspresję czynnika transkrypcyjnego ChREBP-beta i jego celów downstream – co obejmuje enzymy, które działają w ścieżce lipogenezy de novo. Ponadto, niedobór mTORC2 w białych komórkach tłuszczowych skutkuje ciężką wątrobową insulinoopornością. Dane te wskazują, że mTORC2 w białych adipocytach jest istotnym regulatorem metabolizmu węglowodanów i lipidów i jest kluczowym elementem pozawątrobowego mechanizmu komunikacji narządów wyczuwających składniki odżywcze, który kontroluje ogólnoustrojową homeostazę glukozy. Zrozumienie biologii sygnalizacji mTORC2 w tłuszczu białym może zawierać ważne wskazówki, jak biała tkanka tłuszczowa funkcjonuje jako organ wyczuwający glukozę i mediator ogólnoustrojowej sprawności metabolicznej.