Chemistry for Non-Majors
Cele nauczania
- Zdefiniuj promień atomowy.
- Opisać jak zmienia się atom w obrębie okresu.
- Opisać jak promień atomowy zmienia się w obrębie grupy.
Jak ci wszyscy ludzie mogą zmieścić się na tak małej przestrzeni?
 Wydarzenia przyciągają na nie duże ilości ludzi. Nawet impreza plenerowa może zapełnić się tak, że nie ma miejsca na więcej osób. Pojemność tłumu zależy od ilości miejsca w miejscu imprezy, a ilość miejsca zależy od wielkości wypełniających je obiektów. W danej przestrzeni możemy zmieścić więcej ludzi niż słoni, ponieważ słonie są większe od ludzi. W tej samej przestrzeni możemy zmieścić więcej wiewiórek niż ludzi, z tego samego powodu. Znajomość rozmiarów obiektów, z którymi mamy do czynienia, może być ważna przy podejmowaniu decyzji, ile miejsca jest potrzebne.
Wydarzenia przyciągają na nie duże ilości ludzi. Nawet impreza plenerowa może zapełnić się tak, że nie ma miejsca na więcej osób. Pojemność tłumu zależy od ilości miejsca w miejscu imprezy, a ilość miejsca zależy od wielkości wypełniających je obiektów. W danej przestrzeni możemy zmieścić więcej ludzi niż słoni, ponieważ słonie są większe od ludzi. W tej samej przestrzeni możemy zmieścić więcej wiewiórek niż ludzi, z tego samego powodu. Znajomość rozmiarów obiektów, z którymi mamy do czynienia, może być ważna przy podejmowaniu decyzji, ile miejsca jest potrzebne.
Wielkość atomów jest ważna, gdy próbujemy wyjaśnić zachowanie atomów lub związków. Jednym ze sposobów, w jaki możemy wyrazić rozmiar atomów jest promień atomowy . Dane te pomagają nam zrozumieć, dlaczego niektóre cząsteczki pasują do siebie i dlaczego inne cząsteczki mają części, które stają się zbyt zatłoczone w pewnych warunkach.
Rozmiar atomu jest określony przez krawędź jego orbitalu. Jednakże, granice orbitali są rozmyte i w rzeczywistości są zmienne w różnych warunkach. Aby ujednolicić pomiar promienia atomu, mierzy się odległość między jądrami dwóch identycznych atomów połączonych ze sobą. Promień atomowy jest definiowany jako połowa odległości między jądrami identycznych atomów, które są ze sobą związane.

Rysunek 1. Promień atomowy (r) atomu może być zdefiniowany jako połowa odległości (d) między dwoma jądrami w cząsteczce dwuatomowej.
Promienie atomowe zostały zmierzone dla pierwiastków. Jednostkami dla promieni atomowych są pikometry, równe 10-12 metrów. Na przykład, odległość międzyjądrowa pomiędzy dwoma atomami wodoru w cząsteczce H2 jest mierzona jako 74 pm. Zatem promień atomowy atomu wodoru wynosi \frac{74}{2}=37 pm}.
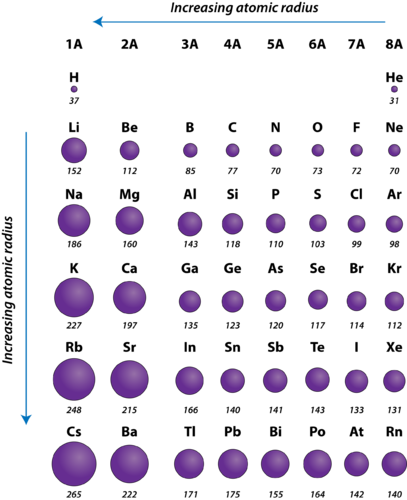
Rysunek 2. Promienie atomowe reprezentatywnych pierwiastków mierzone w pikometrach.
Tendencja okresowa
Promień atomowy atomów generalnie maleje od lewej do prawej w całym okresie. Istnieją pewne małe wyjątki, takie jak promień tlenu, który jest nieco większy niż promień azotu. W danym okresie protony są dodawane do jądra, podczas gdy elektrony są dodawane do tego samego głównego poziomu energetycznego. Elektrony te są stopniowo przyciągane bliżej jądra ze względu na jego zwiększony ładunek dodatni. Ponieważ siła przyciągania pomiędzy jądrami i elektronami wzrasta, rozmiary atomów zmniejszają się. Efekt ten słabnie w miarę przesuwania się dalej w prawo w okresie z powodu odpychania elektron-elektron, które w przeciwnym razie spowodowałoby wzrost rozmiarów atomu.
Tendencja grupowa
Promień atomowy atomów generalnie wzrasta z góry na dół w obrębie grupy. Gdy liczba atomowa wzrasta w dół grupy, ponownie następuje wzrost dodatniego ładunku jądrowego. Jednakże, jest również wzrost w liczbie zajętych głównych poziomów energetycznych. Wyższe główne poziomy energetyczne składają się z orbitali, które mają większe rozmiary niż orbitale z niższych poziomów energetycznych. Efekt większej liczby głównych poziomów energetycznych przeważa nad wzrostem ładunku jądrowego i dlatego promień atomowy rośnie w dół grupy.

Rysunek 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define „atomic radius.”
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.