Choroba z Lyme
Przegląd
Pierwszy przypadek anaplazmozy u ludzi został opisany w 1990 roku, kiedy to u pacjenta z Wisconsin rozwinęła się ciężka choroba gorączkowa po ukąszeniu kleszcza i zmarł on dwa tygodnie później. Wymazy krwi ujawniły skupiska bakterii w neutrofilach pacjenta, podobne do moruli obserwowanych w monocytach przy zakażeniu E. chaffeensis. Jednakże hodowle i testy serologiczne na obecność E. chaffeensis były negatywne. Niemniej jednak, przebieg kliniczny pacjenta sugerował pewnego rodzaju erlichiozę, a kiedy w następnych latach odnotowano kilka dodatkowych przypadków choroby na północnym Środkowym Zachodzie, wysunięto przypuszczenie, że może pojawić się nowy gatunek Ehrlichia. Nowej chorobie nadano wstępnie nazwę „ludzka granulocytarna erlichioza” lub HGE.
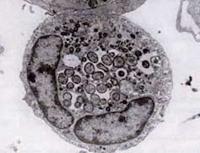
W 1994 roku badania sekwencjonowania DNA ujawniły, że czynnik HGE był wyraźnie różny od E. chaffeensis, ale zasadniczo identyczny z dwoma wcześniej znanymi ehrlichialnymi patogenami weterynaryjnymi, E. equi i E. (Cytoecetes) phagocytophila. Zgodnie z nowym schematem taksonomicznym, który został wprowadzony w życie, te trzy organizmy zostały połączone jako jeden gatunek w ramach nowego rodzaju, Anaplasma. Nowy gatunek jest określany jako Anaplasma phagocytophilum, a choroba, którą wywołuje jest obecnie znana jako ludzka anaplazmoza granulocytarna, lub HGA.
Jak gatunki Ehrlichia, organizmy Anaplasma są małe, gram-ujemne i wewnątrzkomórkowe. A. phagocytophilum atakuje neutrofile, zmienia ich funkcje w organizmie gospodarza i tworzy morule w wakuolach. Większość szkód, które powoduje, wydaje się być związana z procesami zapalnymi gospodarza, ponieważ istnieje niewiele dowodów na korelację pomiędzy liczbą organizmów a ciężkością choroby gospodarza.
Anaplazmoza jest zakażeniem globalnym, występującym w Ameryce Północnej, większości Europy i wschodniej Azji. Wektorami są kleszcze z kompleksu Ixodes persulcatus: I. scapularis w północno-wschodnich i górnych środkowo-zachodnich regionach Stanów Zjednoczonych; I. pacificus w północno-zachodniej części Pacyfiku; I. ricinus w Europie; oraz I. persulcatus w Azji. A. phagocytophilum jest utrzymywana w przyrodzie poprzez przemieszczanie się pomiędzy tymi kleszczami i różnymi małymi ssakami, głównie myszami i innymi małymi gryzoniami. Ponieważ kleszcze Ixodes są również wektorami boreliozy, babeszjozy i kleszczowego zapalenia mózgu, koinfekcja Anaplasma z tymi chorobami może wystąpić i występuje u ludzi.
W Stanach Zjednoczonych liczba przypadków HGA przewyższa liczbę przypadków ludzkiej erlichiozy monocytarnej (HME) Podobnie jak w przypadku HME i ludzkiej erlichiozy ewingii, mediana wieku pacjentów z HGA wynosi około 50 lat.
Objawy i symptomy
Przebieg kliniczny HGA waha się od bezobjawowego zakażenia do śmiertelnej choroby. Początkowe objawy, występujące około pięć do dziesięciu dni po ukąszeniu kleszcza, są w większości niespecyficzne: gorączka, dreszcze, silny ból głowy i bóle mięśni; mogą również wystąpić nudności, kaszel i bóle stawów. Wysypka jest rzadka, ale była zgłaszana.
W porównaniu z HME, HGA wydaje się rzadziej obejmować ośrodkowy układ nerwowy, ale obwodowe neuropatie (np. drętwienie i mrowienie) są bardziej powszechne i mogą trwać od tygodni do miesięcy. Wśród objawów neurologicznych opisywanych w literaturze medycznej znajdują się porażenie twarzy, polineuropatia demielinizacyjna i splot ramienny. Opisywano zespół zaburzeń oddechowych oraz zespół septyczny lub podobny do wstrząsu toksycznego, ale wydaje się, że występują one rzadziej niż w przypadku HME. Ogólny wskaźnik śmiertelności związany z HGA jest bardzo niski (mniej niż 1%), a większość zgonów wynika z zakażeń oportunistycznych (na przykład opryszczkowe zapalenie przełyku, zapalenie płuc wywołane przez Candida i aspergiloza płucna) u pacjentów z obniżoną odpornością.
Diagnostyka
Standardowe badania krwi w HGA zwykle ujawniają wyniki podobne do tych, które są obserwowane w HME: leukopenia, małopłytkowość i zaburzenia funkcji wątroby (podwyższone transaminazy). Jednakże, nieprawidłowości hematologiczne często ustępują w drugim tygodniu od wystąpienia objawów, więc ich brak powinien być interpretowany w tym kontekście, jeśli pacjenci zgłaszają się w późniejszym okresie choroby. Ogólnie rzecz biorąc, należy rozważyć empiryczną antybiotykoterapię u pacjentów z obszarów endemicznych, którzy zgłaszają się z ostrą chorobą gorączkową sugerującą HGA.
Dla celów szczegółowej diagnostyki, rozmaz krwi barwiony metodą Wrighta lub Giemsy daje nieco większą wydajność niż HME, ale nadal nie jest optymalny dla ogólnej użyteczności klinicznej, biorąc pod uwagę, że wydaje się, że istnieje duża różnica (25-75%) w czułości tych testów w wizualizacji moruli w neutrofilach gospodarza. Bardziej pomocne, ale nie zawsze dostępne, są testy łańcuchowej reakcji polimerazy (PCR), których czułość szacuje się na 67-90%. Wcześniejsza antybiotykoterapia drastycznie zmniejsza czułość obu tych metod diagnostycznych.
Badania serologiczne są przydatne do potwierdzenia rozpoznania anaplazmozy. Najczęściej stosowaną metodą jest pośrednia immunofluorescencja (IFA) przeciwciał IgM i IgG przeciwko A. phagocytophilum. Serokonwersja jest prawdopodobnie najbardziej czułym laboratoryjnym dowodem zakażenia A. phagocytophilum, ale nie zawsze jest uzyskiwana w odpowiednim czasie, aby zapewnić użyteczny wkład w decyzje kliniczne (tj. leczenie).