H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
Struktura Lewisa H2S
Struktura Lewisa dowolnego związku jest strukturalną reprezentacją elektronów walencyjnych uczestniczących w tworzeniu wiązania wraz z niewiążącymi parami elektronowymi. Znajomość struktury Lewisa danego związku chemicznego jest niezbędna, ponieważ dostarcza ona niezbędnych informacji o wszystkich innych właściwościach chemicznych związku.
Oprezentacja jest wyświetlana za pomocą kropek i linii, które reprezentują elektrony. Kropki reprezentują elektrony, które nie biorą udziału w tworzeniu wiązań. Natomiast linie reprezentują wiązania w związku. Struktura jest wykonana w oparciu o regułę oktetu. Reguła oktetu w chemii mówi, że powinno być osiem elektronów w zewnętrznej powłoce elementu, aby był stabilny.
Struktura Lewisa siarkowodoru jest łatwa do narysowania i zrozumienia. W tym związku, oba atomy wodoru wymagają jednego elektronu do utworzenia wiązania kowalencyjnego z siarką. Struktura Lewisa dla H2S jest podobna do H2S. Siarka potrzebuje ośmiu elektronów aby spełnić wymagania reguły oktetu. Ale wodór wymaga tylko jednego elektronu, aby stać się stabilnym, ponieważ należy do grupy 1 pierwiastków.
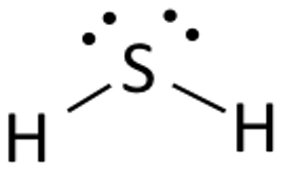
Umieść atom siarki w środku i ułóż wokół niego jego elektrony walencyjne.
Teraz umieść dwa atomy wodoru po obu stronach atomu centralnego.
Tutaj elektrony walencyjne siarki są używane do uczynienia wodoru stabilnym poprzez oddanie elektronu do obu atomów wodoru. Dwa z sześciu elektronów walencyjnych biorą udział w tworzeniu wiązań.
Narysuj linie (dla pokazania wiązań) pomiędzy atomami wodoru i siarki.
Pozostałe cztery elektrony są elektronami niewiążącymi i są wyświetlane jako kropki w pobliżu atomu siarki. W sumie istnieją dwie pary elektronów niewiążących w tym związku i atomy wodoru mają kompletną powłokę walencyjną.
Hybrydyzacja H2S
Aby zrozumieć hybrydyzację H2S, należy najpierw wiedzieć dwie rzeczy:
- Liczba wiązań w związku i ich typ
Znajomość typu wiązania w związku jest niezbędna do poznania jego hybrydyzacji. W cząsteczce H2S dwa atomy wodoru tworzą wiązanie z centralnym atomem siarki. W cząsteczce powstają dwa wiązania pojedyncze. Wiązania te pochłaniają cztery elektrony walencyjne, a więc pozostają jeszcze cztery elektrony walencyjne. Podczas tworzenia wiązania orbitale s atomu wodoru pokrywają się z orbitalami p atomu siarki. Samotna para elektronów zajmuje dwa z orbitali sp3. Pozostałe dwa orbitale sp3 pokrywają się z orbitalem 1s atomu wodoru.
Ten układ prowadzi do hybrydyzacji sp3 cząsteczki H2S. Nałożenie się dwóch orbitali hybrydowych tworzy dwa wiązania sigma pomiędzy atomem wodoru i siarki.
- Liczba steryczna danego związku
Liczba steryczna jest definiowana jako region gęstości elektronów widoczny wokół centralnego atomu. W tym przypadku, ponieważ atomem centralnym jest siarka, liczba steryczna związku będzie sumą liczby atomów związanych z atomem centralnym i liczby samotnych par elektronów wokół atomu centralnego.
Wzór na znalezienie tej liczby to:
Liczba steryczna (SN)
= Liczba wiązań sigma na atomie centralnym + Liczba par samotnych pi na atomie centralnym
W tym przypadku cząsteczki H2S, są dwa wiązania sigma, i są dwie samotne pary elektronów na atomie centralnym.

Tak więc SN cząsteczki H2S = 2+2
=4
Jako że liczba steryczna H2S wynosi cztery, ma on dwa
hybrydowe orbitale i dwie samotne pary elektronów, które czynią go hybrydyzacją sp3.
Gdy znamy już strukturę Lewisa i hybrydyzację cząsteczki, łatwo jest określić jej geometrię molekularną.
H2S Geometria molekularna
Hybrydyzacja danej cząsteczki H2S jest sp3; atom siarki znajduje się w centrum wiązania z dwoma atomami wodoru tworzącymi kąt wiązania mniejszy niż 180 stopni. Zgodnie z teorią VSEPR, samotne pary elektronów odpychają się, ale ponieważ atom Siarki jest mniej elektroujemny, kąt wiązania zmniejsza się do 104,5 stopnia.
To zmniejszenie kąta prowadzi do powstania struktury wygiętej.
Innym sposobem poznania geometrii cząsteczki jest metoda AXN. Gdzie A oznacza centralny atom, X jest dla liczby związanej pary elektronów i N jest dla samotnej pary elektronów. Tutaj ogólna formuła będzie AX2N2 z powodu dwóch par wiążących i dwóch samotnych par elektronów. Tak więc ta cząsteczka wykazuje geometrię wygiętą.
Polaryzacja H2S
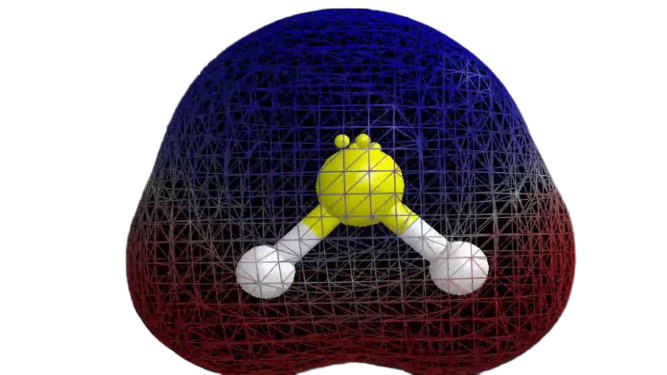
Teraz, gdy mamy wymagane informacje o cząsteczce, łatwo jest określić jej polarność. Polarność każdej cząsteczki zależy od jej geometrii molekularnej i ogólnej elektroujemności. Ponieważ atom siarki jest mniej elektronegatywny, całkowita elektronegatywność związku jest mniejsza niż 0,4, co czyni go niepolarnym.
Więc można powiedzieć, że cząsteczka H2S jest niepolarna.
Uwagi końcowe
Z powyższych informacji można wywnioskować, że cząsteczka H2S ma osiem elektronów walencyjnych, hybrydyzację sp3, wygiętą geometrię molekularną i jest niepolarna.

Uwagi końcowe
Z powyższych informacji można wywnioskować, że cząsteczka H2S ma osiem elektronów walencyjnych, hybrydyzację sp3, wygiętą geometrię molekularną i jest niepolarna.