Klasyfikacja ciężkości przewlekłej obturacyjnej choroby płuc według nowych wytycznych Global Initiative for Chronic Obstructive Lung Disease 2011: COPD Assessment Test Versus Modified Medical Research Council Scale | Archivos de Bronconeumología
Wprowadzenie
Przewlekła obturacyjna choroba płuc (POChP) dotyka 9,1% dorosłej populacji Hiszpanii w wieku od 40 do 69 lat i jest jedną z głównych przyczyn zgonów z powodu chorób niezakaźnych na świecie.1,2 Wytyczne postępowania w POChP określają, że diagnostyka musi obejmować spirometrię. Badanie to pozwala sklasyfikować stopień zaawansowania choroby na podstawie odsetka FEV1 w stosunku do wartości przewidywanej (FEV1%), a następnie odpowiednio określić strategię leczenia.3,4 Procedura ta jednak stosunkowo słabo koreluje ze śmiertelnością pacjentów i symptomatologią.5 Wielowymiarowa ocena, która obejmuje nie tylko czynność płuc, ale także ilościowe określenie objawów (np. skale duszności), stanu odżywienia pacjenta i wydolności wysiłkowej, taka jak wskaźnik BODE,6 przyczyniła się do zmiany sposobu postrzegania tej choroby.7
Rewizja Global Initiative for Chronic Obstructive Lung Disease (GOLD 2011) proponuje stratyfikację pacjentów w zależności od stopnia ciężkości choroby, z uwzględnieniem objawów określanych za pomocą zmodyfikowanej skali Medical Research Council (mMRC) lub stanu zdrowia za pomocą testu oceny POChP (CAT), a także historii zaostrzeń choroby i FEV1% po rozkurczu płuc (pb).8 Pacjenci są klasyfikowani w zależności od ryzyka: małe ryzyko (pbFEV1%≥50% lub 1
% bez objawów (CAT10 lub mMRC 0-1) lub więcej objawów (CAT≥10 lub mMRC≥2). W ten sposób wyodrębniono cztery kategorie: A (niskie ryzyko, mniej objawów), B (niskie ryzyko, więcej objawów), C (wysokie ryzyko, mniej objawów), D (wysokie ryzyko, więcej objawów). Proponowane podejście terapeutyczne jest inne dla każdej z grup8 (ryc. 1).
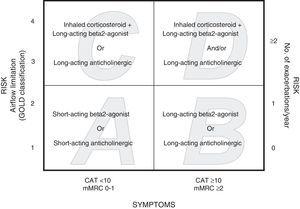
Kategorie GOLD 2011 i leczenie farmakologiczne (pierwsza rekomendacja) dla każdej kategorii.
Celem tego badania było określenie na podstawie kohorty badania obserwacyjnego (BODE Center, Saragossa, Hiszpania), czy wybór skali objawów (mMRC) lub kwestionariusza mierzącego jakość życia (CAT) jest źródłem różnic w przypisaniu do różnych kategorii ciężkości i odpowiadających im implikacji terapeutycznych.
Pacjenci i metodyProjekt badania
Projekt BODE jest wieloośrodkowym badaniem obserwacyjnym mającym na celu ocenę naturalnej historii POChP. Pacjenci zostali wstępnie wybrani w latach 1996-2000 i byli obserwowani co roku. Protokół i główne wyniki zdrowotne zostały opisane wcześniej.6 Rozpoznanie POChP ustalono zgodnie z kryteriami GOLD8: pbFEV1%/FVC%20 pack-years. W okresie od stycznia 2010 r. do września 2012 r. w naszym ośrodku oceniono 283 nowych pacjentów i ta ostatnia grupa została wykorzystana do niniejszej analizy.
Procedury
Standaryzowane pomiary w kohorcie BODE obejmowały dane demograficzne, dokumentację kliniczną oraz kwestionariusze dotyczące zdrowia i jakości życia, w tym CAT i mMRC. Obie oceny były przeprowadzane tego samego dnia i przez tego samego ankietera dla każdego pacjenta.
Kwestionariusz CAT jest samopodawanym narzędziem do oceny jakości życia pacjenta z POChP. Składa się z 8 pozycji i pozwala uzyskać wynik od 0 do 40 punktów; wyższy wynik wskazuje na gorszy stan zdrowia.9 Skala duszności mMRC jest narzędziem pozwalającym określić nasilenie duszności w odniesieniu do różnych zadań fizycznych. Składa się z 5 pozycji i jest oceniana w zakresie od 0 (brak duszności lub tylko przy dużym wysiłku) do 4 (duszność w spoczynku).10
Spirometrię wykonywano przed i 20-30 min po inhalacji 200 μg salbutamolu zgodnie ze standardową procedurą.11 Wszyscy chorzy wykonywali 6-minutowy test chodu.
Przypisanie chorych do kategorii GOLD 2011 ustalano niezależnie, posługując się skalą mMRC (duszność) i skalą CAT (jakość życia). Zasady stratyfikacji określają, że najpierw pacjent musi zostać zakwalifikowany do grupy A lub C, gdy wynik w skali mMRC wynosi 0-1 lub CAT Rys. 1). Następnie należy ustalić ryzyko chorego, stosując jedną z dwóch procedur. W przypadku jednej procedury pacjenci z pbFEV1%≥50% są przypisywani do kategorii A lub B (niskie ryzyko), a pacjenci z pbFEV18 Zaostrzenie definiowano jako ciężkie, gdy pacjent był widziany w izbie przyjęć lub przyjęty do szpitala. Dane o poprzednich zaostrzeniach uzyskano z kwestionariuszy rozdawanych pacjentom oraz z baz danych systemu intranetowego Służby Zdrowia Aragonii. Do określenia ryzyka wybrano wyższy wskaźnik pomiędzy ograniczeniem przepływu powietrza mierzonym pbFEV1% a historią zaostrzeń.
Analiza statystyczna
Przeprowadzono analizę opisową charakterystyki pacjentów włączonych do serii. Analizie poddano dane dotyczące zmiennych demograficznych i klinicznych, testów czynnościowych układu oddechowego oraz testów wysiłkowych. Kohortę pacjentów podzielono na cztery kategorie, zgodnie z kryteriami GOLD 2011 (A, B, C i D), wykorzystując kwestionariusz CTA oraz alternatywnie skalę mMRC. Stopień zgodności między wynikami uzyskanymi z zastosowania obu metod w tej samej kohorcie chorych określono, obliczając ważony wskaźnik kappa (κ) (zgodność lub zgodność między porządkowymi jakościowymi testami diagnostycznymi). Korelację Spearmana (nieparametryczny estymator rho ) obliczono w celu oceny spójności pomiędzy dwoma metodami oceny zapisanymi w porządkowej skali jakościowej. Test ANOVA zastosowano do porównania średnich zmiennych klinicznych i funkcjonalnych w czterech kategoriach GOLD 2011, w zależności od tego, czy do klasyfikacji pacjentów zastosowano jedną czy drugą metodę oceny. Analizy przeprowadzono przy użyciu oprogramowania SPSS 19.0®.
Wyniki
Z 283 pacjentów włączonych do badania 260 (92%) stanowili mężczyźni, a 23 (8%) kobiety. Średnia wieku wyniosła 71±12 lat. Główne zmienne demograficzne, kliniczne i funkcjonalne przedstawiono w Tabeli 1. Tabela 2 przedstawia te zmienne pogrupowane według płci wraz z oceną ewentualnych istotnych różnic pomiędzy poszczególnymi analizowanymi parametrami. W czasie tej wizyty 70 (24,7%) chorych było nadal czynnymi palaczami. Średnia wartość pbFEV1% wynosiła 62,4±19,9%. Na rycinie 2 przedstawiono rozkład pacjentów w zależności od wartości CAT i mMRC; korelację obliczono za pomocą współczynnika Spearmana ρ=0,613.
Zmienne demograficzne, kliniczne i funkcjonalne (średnia±odchylenie standardowe).
| Total | 283 patients |
| Sex | 260 (92%) males; 23 (8%) females |
| Age | 71±12 years |
| BMI | 28.5±4.8 |
| Active smoker | 70 patients (24.7%) |
| PYI | 61.8±36.77 |
| Comorbidities | HT: 152 patients (53.7%); dyslipidemia: 106 (37.5%); diabetes: 53 (18.7%); cardiovascular episodes: 124 (43.8%); no comorbidity: 48 (17%) |
| pbFEV1% | 62.4%±20.3 |
| PBD(+) | 33 patients (11.6%) |
| Baseline SatO2 | 93.9%±6.3 |
| Walking test | 389.2m±96.2 |
| Spirometry results | |
| FVC | 2.8l±0.8 |
| FVC% | 76.8%±19.8 |
| FEV1 | 1.6l±0.6 |
| FEV1% | 57.5%±19.9 |
| FEV1/FVC | 0.54±0.12 |
| FEV1/FVC% | 0.74±0.17 |
| pbFVC | 3.07l±0.86 |
| pbFVC% | 82.8%±19.25 |
| pbFEV1 | 1.7l±0.7 |
| pbFEV1% | 62.4%±20.3 |
| pbFEV1/FVC | 0.55±0.13 |
| pbFEV1/FVC % | 0.75±17.8 |
FEV1%: forced expiratory volume in one second, percentage of predicted value; FVC: forced vital capacity; HT: hypertension; BMI: body mass index; PYI: pack-year index; pb: post-bronchodilator; PBD(+): positive bronchodilator test; SatO2: oxygen saturation.
Demographic, Clinical and Functional Variables by Sex (Mean±Standard Deviation).
| Males | Females | P | |
| n | 260 (92%) | 23 (8%) | |
| Age | 71.3 years±7.5 | 64.5 years±8.6 | NS (P=.3) |
| BMI | 28.6±4.7 | 27.3±7.1 | P |
| Active smoker | 60 (23.1%) | 10 (43.5%) | P |
| PYI | 62.6±33.5 | 53.3±21 | P |
| pbFEV1% | 62.9%±20.1 | 57.5%±21.8 | NS (P |
| PBD(+) | 29 (11.1%) | 4 (17.4%) | NS (P=.36) |
| Baseline SatO2 | 93.3%±6.5 | 93.4%±2.7 | NS (P |
| Walking test | 390.1m±95.1 | 380.3m±111 | NS (P |
FEV1%: forced expiratory volume in one second, percentage of predicted value; BMI: body mass index; PYI: pack-year index; NS: not significant; pb: post-bronchodilator; PBD(+): positive bronchodilator test; SatO2: oxygen saturation.
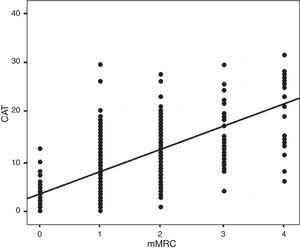
Distribution of mMRC vs CAT. Spearman correlation index: ρ=0.613; P
When the CAT questionnaire was used for classifying patients according to the GOLD 2011 criteria, the percentage distribution of patients to the groups was the following: category A, 34.3%; category B, 19.4%; category C, 19.8%, and category D, 26.5%. When the mMRC was applied, the result was: category A, 36.4%; category B, 17.3%; category C, 18.0%, and category D, 28.3% (Table 3 and Fig. 3).
Cohort GOLD 2011 Classification With CAT and mMRC (Fig. 3).
| GOLD CAT | GOLD mMRC | ||||
| A | B | C | D | Total | |
| A | 81 | 16 | 0 | 0 | 97 (35%) |
| B | 22 | 33 | 0 | 0 | 55 (19%) |
| C | 0 | 0 | 34 | 22 | 56 (20%) |
| D | 0 | 0 | 17 | 58 | 75 (26%) |
| Total | 103 (36%) | 49 (17%) | 51 (18%) | 80 (29%) | 283 (100%) |
Explanatory note: Gdy zastosowano skalę mMRC, 103 pacjentów zostało sklasyfikowanych jako A; spośród nich 22 zostało sklasyfikowanych jako B, gdy zastosowano kwestionariusz CAT. Podobnie, gdy zastosowano CAT, 97 pacjentów zostało sklasyfikowanych jako A, ale 16 z nich zostało następnie sklasyfikowanych jako B przy użyciu mMRC. Przy zastosowaniu mMRC 49 pacjentów zostało sklasyfikowanych jako B, ale 16 z nich zostało sklasyfikowanych jako A przy zastosowaniu CAT; przy zastosowaniu CAT 55 pacjentów zostało sklasyfikowanych jako B, ale 22 z nich zostało sklasyfikowanych jako A przy zastosowaniu mMRC. Podobna sytuacja występowała w przypadku kategorii C i D, w zależności od tego, czy stosowano jeden czy drugi kwestionariusz. Nie zaobserwowano migracji między kategoriami AB i CD, ponieważ zależy to od kryteriów ryzyka (AB: niskie ryzyko; CD: wysokie ryzyko), co widać na ryc. 1.
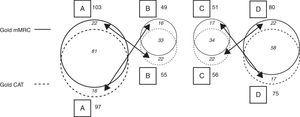
Schematic of migration between GOLD categories depending on results of the application of CAT or mMRC (see distribution of data and explanatory note in Table 3).
When the results from the application of both evaluation methods were examined, it was found that in category A, the classification of 81 patients coincided (83.5% of those classified using CAT and 78.6% of those classified with mMRC). In category B, the classification of 33 patients coincided (60% of those classified with CAT and 67.34% of those classified with mMRC). W kategorii C zbieżna była klasyfikacja 34 pacjentów (60,7% osób z CAT i 66,7% osób z mMRC). W kategorii D, klasyfikacja 58 pacjentów była zbieżna (77,3% klasyfikowanych za pomocą CAT i 72,5% klasyfikowanych za pomocą mMRC) (tab. 3 i ryc. 3).
Współczynnik κ dla klasyfikacji pacjentów za pomocą 2 metod wynosił 0,63, wskazując na umiarkowany stopień zgodności. Obliczony wskaźnik κ wyniósł 0,44 dla 152 pacjentów przypisanych do kategorii A i B (umiarkowanie słaby stopień zgodności). Wskaźnik dla 131 pacjentów zakwalifikowanych do kategorii C i D wyniósł 0,38, co wskazuje na jeszcze gorszy stopień zgodności (słaby). Oznacza to, że dla kategorii niskiego ryzyka (A i B) uzyskana zgodność wynosiła 75%, natomiast dla kategorii wysokiego ryzyka (C i D) zgodność wynosiła 70%.
The clinical and functional characteristics of the patients in each of the GOLD 2011 categories, depending on the method applied (CAT or mMRC), are shown in Table 4. There were no differences in the categories for age and body mass index (BMI) between patients classified by mMRC or CTA. Only the pack-year index (PYI) was significantly different between category D and the other categories, regardless of whether the classification was made by mMRC or CAT (PP
PP=.003).
Main Clinical and Functional Characteristics of Patients Assigned to GOLD 2011 Categories, as Classified Using mMRC or CAT.
| mMRC | A | B | C | D | CAT | A | B | C | D |
| Age | 70.3 | 70.5 | 69.1 | 72.3 | Age | 71.3 | 68.8 | 70.1 | 71.8 |
| BMI | 28.6 | 29.1 | 28.1 | 28.2 | BMI | 28.5 | 29.3 | 28.1 | 28.2 |
| PYI | 58.4 | 62.3 | 55.7 | 69.7a | PYI | 58.35 | 61.96 | 55.40 | 70.86a |
| pb FEV1% | 75.3 | 69.1 | 56.3 | 44.5 | pb FEV1% | 73.4 | 73.1 | 54.6 | 45.2 |
| Walking test | 414 | 364b | 417 | 344c | Walking test | 400 | 396 | 400 | 354d |
Values expressed as means for each category.
P
P
P
P=.003 vs category C.
Discussion
The recent revision of the GOLD 2011 guidelines proposes that when classifying COPD patients, the medical community should take into consideration not only functional deterioration, but also symptoms and risk of exacerbations.8 W celu ustalenia stopnia pogorszenia czynnościowego zaproponowano utrzymanie takich samych stopni ciężkości jak obecnie stosowane, czyli łagodnych (pbFEV1%>80%), umiarkowanych (pbFEV1%≥80% i 1
%≥30% i 1% 30%). Ryzyko wystąpienia zaostrzenia określono na podstawie historii zaostrzeń w roku poprzedzającym ocenę (10 i duży wpływ dla CAT≥10). Nasze wyniki sugerują, że zastosowanie jednej lub drugiej metody oceny zmienia przyporządkowanie znacznej liczby chorych do jednej lub drugiej kategorii ciężkości POChP według nowych wytycznych GOLD. Nie można więc traktować tych metod oceny jako równoważnych, gdyż w zależności od zastosowania jednej lub drugiej metody u danego chorego zalecane są różne strategie leczenia.
Kwestionariusz CAT odzwierciedla wpływ choroby na stan zdrowia pacjenta. Jest to specyficzny kwestionariusz jakości życia dla POChP5,9,12,13, który ocenia nie tylko duszność, ale także inne objawy oddechowe, takie jak obecność i nasilenie kaszlu lub plwociny; zawiera także 8 pozycji, w tym zdolność do wysiłku fizycznego, sen i czynności życia codziennego, dając wynik od 0 do 40 punktów. CAT jest prostym kwestionariuszem i może być wykorzystywany w standardowej praktyce klinicznej. Wykazano jego przydatność do różnicowania stopnia ciężkości choroby.9,12,14,15 Nie jest on jednak narzędziem diagnostycznym; jego celem jest uzupełnienie informacji uzyskanych z pomiarów czynności płuc i niewiele wiadomo o jego potencjalnej roli prognostycznej.14 Kwestionariusz ten jest szczególnie wrażliwy na wpływ zmian stanu zdrowia po zaostrzeniach16 i wpływ rehabilitacji oddechowej.17 W ostatnim przeglądzie potwierdzono przydatność CAT (wśród innych specyficznych kwestionariuszy) jako narzędzia do pomiaru jakości życia w POChP, szczególnie w porównaniu z innymi narzędziami ogólnymi. Niestety, w przeglądzie tym nie analizowano ważności roli mMRC.5 MMRC jest skalą duszności, która jest łatwiejsza w użyciu, zwłaszcza w podstawowej opiece zdrowotnej,18 i może być włączona do wielowymiarowych narzędzi oceny POChP, takich jak BODE6 i ADO (age, dyspnea, obstruction).19 Ponadto duszność lepiej koreluje z jakością życia chorych na POChP niż obiektywne parametry czynnościowe.10,15 Kliniczne określenie duszności ujawnia wydolność czynnościową chorego i jest miarą skuteczności leczenia,20 a jednocześnie ściśle koreluje z 5-letnim przeżyciem chorych na POChP.21 Wykazano również większą zdolność predykcyjną w odniesieniu do wyników rehabilitacji oddechowej, niezależnie od stopnia obturacji.6,18,21
Nie stwierdzono istotnych różnic w wieku, BMI i FEV1 między chorymi w grupach A i B oraz C i D, niezależnie od tego, czy zostali sklasyfikowani za pomocą mMRC czy CAT. Jednak wydolność wysiłkowa pacjentów z grup B vs A i D vs C jest niższa, gdy są oni klasyfikowani za pomocą mMRC, a nie CAT. Sugeruje to, że duszność jest znacznie ważniejsza niż jakość życia jako zmienna wpływająca na codzienne życie chorych na POChP.
Chorzy na POChP włączeni do naszej kohorty mają podobną charakterystykę demograficzną, kliniczną i funkcjonalną jak chorzy z innych badań opublikowanych w piśmiennictwie, a rozkład chorych w poszczególnych kategoriach jest również podobny.22 W naszej serii korelacja uzyskana pomiędzy zastosowaniem CAT lub mMRC była umiarkowana (ρ=0,613) i podobna do korelacji uzyskanej w innym przekrojowym badaniu kohortowym.13 Zgodnie z naszymi wynikami, zastosowanie CAT lub mMRC do klasyfikacji pacjentów do nowych kategorii GOLD 2011 oznaczałoby zmianę klasyfikacji pacjentów do kategorii niskiego (A i B) i wysokiego ryzyka (C i D). Wyliczenie wskaźnika zgodności w zależności od zastosowania CAT lub mMRC jest umiarkowanie słabe dla kategorii A-B (κ=0,44), a jeszcze słabsze dla kategorii C-D (κ=0,38). W wartościach względnych przekłada się to na zgodność 75% w kategoriach A i B oraz 70% w kategoriach C i D. Tak więc stosowanie tych dwóch metod oceny nie jest równoważne, a ponad 25% pacjentów zostaje przeklasyfikowanych po zastosowaniu jednej lub drugiej metody. Wynik ten ma znaczący wpływ na strategie leczenia przeklasyfikowanych pacjentów. Największe różnice w leczeniu występują pomiędzy kategoriami A (zalecane leczenie farmakologiczne pierwszego rzutu oparte jest na krótko działających bronchodilatorach) i B (zalecane leczenie farmakologiczne pierwszego rzutu oparte jest na długo działających bronchodilatorach i rehabilitacji pulmonologicznej). Różnice między kategoriami C i D były niewielkie, dotyczyły jedynie alternatywnych opcji leczenia farmakologicznego, natomiast zalecenia dotyczące leczenia nielekowego są takie same.8
W najnowszym badaniu, w którym również porównano wyniki zastosowania obu metod oceny, stwierdzono, że nowa klasyfikacja GOLD 2011 może wymagać pewnej korekty. Autorzy ci proponują nowy punkt odcięcia dla stosowania skali mMRC (mało objawów=0; więcej objawów≥1).23 W dwóch kolejnych badaniach, również najnowszych, przeprowadzonych w Korei Południowej i w Stanach Zjednoczonych, w bardzo różnych środowiskach geograficznych i socjokulturowych, które nie różnią się od Hiszpanii, uzyskano wyniki identyczne z naszymi i wyciągnięto podobne wnioski. W jednym z tych badań analizowano 257 południowokoreańskich pacjentów w jednym ośrodku i uzyskano wyniki identyczne z naszymi.24 Drugie badanie było badaniem wieloośrodkowym, do którego włączono 4484 północnoamerykańskich pacjentów z POChP, w ramach badania COPDGene. Analizowali oni wyniki zastosowania mMRC lub kwestionariusza SGRQ (jako surogatu CAT) i doszli do podobnego wniosku, że wybór jednego lub drugiego narzędzia do pomiaru objawów wpływa na przypisanie kategorii.25
W najnowszej rewizji GOLD 2013 ocena chorych na POChP została wzbogacona o włączenie Kwestionariusza Klinicznego POChP (Clinical COPD Questionnaire, CCQ).26 W początkowej części rewizji, Metodologia i Podsumowanie nowych zaleceń, a dalej w części Ocena objawów, wyraźnie zaznaczono, że jest to kwestionariusz do samodzielnego wypełniania, zaprojektowany specjalnie do pomiaru monitorowania klinicznego chorych na POChP. W rewizji podkreślono, że dane potwierdzają ważność, wiarygodność i czułość tego krótkiego i łatwego do podawania kwestionariusza. Określa, że na podstawie obecnej wiedzy punkt odcięcia CCQ=0-1 może być brany pod uwagę przy klasyfikowaniu pacjentów do grup A i C, a wynik CCQ>1 może być używany do klasyfikowania pacjentów do grup B lub D. Autorzy deklarują jednak, że potrzebne są dalsze badania w celu walidacji zdolności dyskryminacyjnej i praktycznych implikacji CCQ w wykrywaniu zaostrzeń w codziennej opiece. Następnie, w części poświęconej łącznej ocenie POChP, utrzymano tę samą propozycję łącznej oceny przedstawioną w wytycznych GOLD 2011, opartą wyłącznie na CAT lub mMRC do objawowej oceny stopnia zajęcia POChP, bez wyraźnej wzmianki o CCQ26
Przedstawione badanie ma pewne ograniczenia: wielkość próby jest stosunkowo niewielka, chociaż większość badań dotyczących instrumentów do pomiaru POChP obejmuje podobną lub mniejszą liczbę pacjentów.5,24 Ponadto, ponieważ nie jest to badanie przekrojowe, nie odnotowano wartości prognostycznej wyników. Nie ustalono również korelacji z chorobami współistniejącymi pomiędzy poszczególnymi kategoriami. Choroby współistniejące występujące u chorych mogą mieć istotny wpływ na rokowanie i powinny być brane pod uwagę przy łącznej ocenie POChP w każdej przyszłej rewizji wytycznych GOLD.27
Wnioski
Klasyfikacja chorych na POChP do kategorii zgodnie z łączną oceną zaproponowaną przez rewizję GOLD 2011 różni się w zależności od metody oceny stosowanej w ocenie objawowej chorych (CAT lub mMRC). Ponad 25% pacjentów w różnych kategoriach zostaje przeklasyfikowanych w przypadku zastosowania jednej lub drugiej metody, co implikuje różnice w zalecanej strategii leczenia. Konieczne są badania podłużne w celu oceny, która metoda oceny najlepiej klasyfikuje pacjenta, ze zwróceniem uwagi na możliwości prognostyczne takich instrumentów.
Konflikt interesówAutorzy deklarują, że nie mają konfliktu interesów w przygotowaniu tego manuskryptu.