Rodzina tlenowa
Rodzina tlenowa składa się z pierwiastków, które tworzą grupę 16 na układzie okresowym: tlen, siarka, selen, tellur i polon. Wszystkie te elementy mają sześć elektronów w ich najbardziej zewnętrznym poziomie energetycznym, co odpowiada za pewne wspólne właściwości chemiczne wśród nich. Pod innym względem pierwiastki te różnią się od siebie. Tlen jest niemetalem w stanie gazowym; siarka i selen są niemetalami w stanie stałym; tellur jest metaloidem w stanie stałym; a polon jest metalem w stanie stałym.
Słowa, które warto znać
Kwasy: Substancje, które po rozpuszczeniu w wodzie są w stanie reagować z zasadą, tworząc sole i uwalniając jony wodorowe.
Alotrop: Jedna z dwóch lub więcej form danego pierwiastka.
Spalanie: Forma utleniania, która zachodzi tak szybko, że powstaje zauważalne ciepło i światło.
Kraking: Proces, w którym duże cząsteczki węglowodorów są rozbijane na mniejsze składniki.
Elektroliza: Proces, w którym prąd elektryczny powoduje zmianę chemiczną, zwykle rozpad jakiejś substancji.
Izotopy: Dwie lub więcej form tego samego pierwiastka z taką samą liczbą protonów, ale różną liczbą neutronów w jądrze atomowym.
Litosfera: Stała część Ziemi, zwłaszcza zewnętrzny obszar skorupy ziemskiej.
LOX: Skrót od nazwy ciekły tlen.
Metalurgia: Nauka i technologia, która zajmuje się pozyskiwaniem metali z ich rud i przekształcaniem ich w formy, które mają wartość praktyczną.
Nascent oxygen: Alotrop tlenu, którego cząsteczki zawierają po jednym atomie tlenu.
Ozon: Alotrop tlenu, który składa się z trzech atomów w cząsteczce.
Gaz generatorowy: Paliwo syntetyczne, które składa się przede wszystkim z tlenku węgla i wodoru.
Białka: Duże molekuły, które są niezbędne do budowy i funkcjonowania wszystkich żywych komórek.
Rozpad radioaktywny: Przewidywalny sposób, w jaki populacja atomów pierwiastka promieniotwórczego ulega spontanicznemu rozpadowi w czasie.
Tlen
Tlen jest bezbarwnym, bezwonnym, pozbawionym smaku gazem o temperaturze topnienia -218°C (-360°F) i temperaturze wrzenia -183°C (-297°F). Jest to najobficiej występujący pierwiastek w skorupie ziemskiej, stanowiący około jednej czwartej masy atmosfery, około połowy litosfery (skorupy ziemskiej) i około 85% hydrosfery (oceanów, jezior i innych form wody). Występuje zarówno jako wolny pierwiastek, jak i w wielu różnych związkach. W atmosferze występuje jako tlen elementarny, czasami nazywany dwutlenkiem, ponieważ składa się z dwuatomowych cząsteczek, O 2 . W wodzie występuje jako tlenek wodoru, H 2 O, a w litosferze występuje w związkach takich jak tlenki, węglany, siarczany, krzemiany, fosforany i azotany.
Tlen występuje również w dwóch formach alotropowych (fizycznie lub chemicznie różne formy tej samej substancji): jeden atom w cząsteczce (O) i trzy atomy w cząsteczce (O 3 ). Pierwszy alotrop znany jest jako tlen monatomowy lub rodzący się, a drugi jako tlen trójatomowy lub ozon. W większości warunków w przyrodzie dominuje forma dwuatomowa tlenu. Jednak w górnej części stratosfery energia słoneczna powoduje rozpad formy dwuatomowej na formę jednoatomową, która może następnie rekombinować z cząsteczkami dwuatomowymi, tworząc ozon. Obecność ozonu w atmosferze Ziemi jest krytyczna dla przetrwania życia na Ziemi, ponieważ ten alotrop ma tendencję do pochłaniania promieniowania ultrafioletowego, które w przeciwnym razie byłoby szkodliwe lub nawet śmiertelne dla życia roślinnego i zwierzęcego na powierzchni planety.
Tlen został odkryty niezależnie przez szwedzkiego chemika Carla Scheele (1742-1786) i angielskiego chemika Josepha Priestleya (1733-1804) w latach 1773-1774. Nazwa pierwiastka została nadana pod koniec lat siedemdziesiątych XVII wieku przez francuskiego chemika Antoine’a Laurenta Lavoisiera (1743-1794). Jego nazwa pochodzi od francuskiego słowa oznaczającego „kwasotwórczy”, odzwierciedlając błędne przekonanie Lavoisiera, że wszystkie kwasy zawierają tlen.
Produkcja. Zdecydowanie najbardziej powszechną metodą komercyjnej produkcji tlenu jest destylacja frakcyjna ciekłego powietrza. Próbka powietrza jest najpierw schładzana do bardzo niskiej temperatury w zakresie -200°C (-330°F). W tej temperaturze większość gazów wchodzących w skład powietrza staje się cieczą. Ciekłe powietrze jest następnie pozostawiane do odparowania. W temperaturze około -196°C (-320°F) azot zaczyna wrzeć. Gdy większość azotu zniknie, argon i neon również się zagotują, pozostawiając po sobie nieczystą formę tlenu. Tlen jest nieczysty, ponieważ w ciekłej postaci mogą pozostać niewielkie ilości kryptonu, ksenonu i innych gazów. W celu dalszego oczyszczenia tlenu, proces chłodzenia, skraplania i odparowywania może być powtarzany.
Tlen jest powszechnie przechowywany i transportowany w postaci ciekłej, znanej również jako LOX (od l iquid ox ygen). Pojemniki LOX wyglądają jak bardzo duże butle próżniowe składające się z dwuściennego pojemnika z próżnią między ściankami. Pierwiastek ten może być również przechowywany i transportowany mniej łatwo w postaci gazowej w pojemnikach o stalowych ściankach o wysokości około 1,2 metra (4 stóp) i średnicy 23 centymetrów (9 cali). W wielu przypadkach tlen jest produkowany w miejscu, w którym będzie używany. Opisany wcześniej proces destylacji frakcyjnej jest na tyle prosty i niedrogi, że wiele gałęzi przemysłu może zapewnić sobie własne urządzenia do produkcji tlenu.
Zastosowania. Tlen ma tak wiele zastosowań komercyjnych, przemysłowych i innych, że konsekwentnie plasuje się w pierwszej piątce chemikaliów pod względem wielkości produkcji w Stanach Zjednoczonych. Na przykład w 1990 roku w Stanach Zjednoczonych wyprodukowano około 18 miliardów kilogramów (39 miliardów funtów) tego pierwiastka.
Zastosowania tlenu można podzielić na cztery główne kategorie: metalurgia, rakiety, synteza chemiczna i medycyna. W procesie przetwarzania rudy żelaza w wielkim piecu, na przykład, tlen jest używany do przekształcania koksu (węgla) w tlenek węgla. Tlenek węgla z kolei redukuje tlenki żelaza do czystego metalu. Tlen jest następnie wykorzystywany w drugim etapie przetwarzania żelaza w konwertorze Bessemera, otwartym palenisku lub podstawowej metodzie tlenowej przetwarzania „surówki” na stal. Na tym etapie tlen jest używany do reakcji z nadmiarem węgla, krzemu i metali pozostałych w surówce, które muszą być usunięte w celu wytworzenia stali.
Innym metalurgicznym zastosowaniem tlenu są palniki używane do spawania i cięcia. Dwa najczęściej spotykane palniki wykorzystują reakcję pomiędzy tlenem i wodorem (palnik tlenowo-wodorowy) lub pomiędzy tlenem i acetylenem (palnik oksyacetylenowy). Oba rodzaje palników wytwarzają temperatury w zakresie 3000°C (5400°F) lub wyższe i dlatego mogą być używane do przecinania lub spawania większości materiałów metalicznych.
W postaci LOX, tlen jest szeroko stosowany jako utleniacz w wielu rodzajach rakiet i pocisków. Na przykład, ogromny zewnętrzny zbiornik paliwa wymagany do wyniesienia promu kosmicznego w przestrzeń kosmiczną mieści 550 000 litrów (145 000 galonów) ciekłego tlenu i 1 500 000 litrów (390 000 galonów) ciekłego wodoru. Gdy te dwa pierwiastki reagują w głównych silnikach wahadłowca, zapewniają maksymalny ciąg 512 000 funtów.
Przemysł chemiczny zużywa ogromne ilości tlenu każdego roku w różnych reakcjach syntezy (tworzenia) chemicznej. Jedną z najważniejszych z nich jest krakowanie węglowodorów przy użyciu tlenu. W większości przypadków ogrzewanie węglowodoru z tlenem prowadzi do spalania, którego głównymi produktami są dwutlenek węgla i woda. Jednakże, jeśli szybkość, z jaką tlen jest dostarczany do mieszaniny węglowodorów jest starannie kontrolowana, węglowodory są „krakowane” lub rozbijane w celu wytworzenia innych produktów, takich jak acetylen, etylen i propylen.
Różne rodzaje paliw syntetycznych mogą być również wytwarzane przy użyciu tlenu jako jednego z głównych reagentów. Na przykład gaz generatorowy jest wytwarzany przez przepuszczanie tlenu w kontrolowanym tempie przez złoże gorącego węgla lub koksu. Większość dwutlenku węgla powstającego w tej reakcji jest redukowana do tlenku węgla, tak że produkt końcowy (gaz generatorowy) składa się głównie z tlenku węgla i wodoru.
Prawdopodobnie najbardziej znanym zastosowaniem tlenu w medycynie jest terapia tlenowa, w której pacjentom mającym problemy z oddychaniem podaje się dawki czystego lub prawie czystego tlenu. Tlenoterapia jest często stosowana podczas zabiegów chirurgicznych, porodu, rekonwalescencji po zawale serca oraz podczas leczenia chorób zakaźnych. W każdym z tych przypadków podawanie czystego tlenu zmniejsza obciążenie serca i płuc, co przyspiesza powrót do zdrowia.
Czysty tlen lub powietrze wzbogacone tlenem może być również dostarczane w środowiskach, w których oddychanie może być utrudnione. Samoloty, które latają na dużych wysokościach, są oczywiście zawsze zaopatrzone w zapas tlenu na wypadek problemów z normalnym zaopatrzeniem statku w powietrze. Nurkowie głębinowi również noszą ze sobą lub mają pompowane do nich zapasy powietrza wzbogaconego tlenem.
Niektóre zakłady oczyszczania wody i ścieków używają tlenu. Gaz jest pompowany przez wodę, aby zwiększyć tempo, w którym naturalnie występujące bakterie rozkładają organiczne materiały odpadowe. Stwierdzono, że podobny proces zmniejsza tempo, w jakim zachodzi eutrofizacja w jeziorach i stawach, a w niektórych przypadkach faktycznie odwraca ten proces. (Eutrofizacja to rozpuszczanie się składników odżywczych w zbiorniku wodnym. Wzrost roślinności wodnej i spadek ilości rozpuszczonego tlenu to dwa główne rezultaty tego procesu).
Wreszcie, tlen jest niezbędny dla wszystkich zwierząt żyjących na Ziemi. Człowiek może przeżyć kilka dni lub tygodni bez wody lub jedzenia, ale nie więcej niż kilka minut bez tlenu. W przypadku braku tlenu, generujące energię reakcje chemiczne zachodzące w komórkach zakończyłyby się, a człowiek umarłby.
Siarka
Siarka jest pierwiastkiem niemetalicznym, który może występować w wielu formach alotropowych (fizycznie lub chemicznie różne formy tej samej substancji). Najbardziej znane z nich to siarka rombowa i monokliniczna. Obie są jasnożółtymi ciałami stałymi o temperaturze topnienia około 115°C (239°F). Trzecia forma nazywana jest siarką plastyczną lub amorficzną. Jest to brązowawy płyn produkowany, gdy siarka rombowa lub monokliniczna jest topiona.
Siarka sama w sobie nie ma żadnego zapachu. Ma jednak złą reputację w tym względzie, ponieważ niektóre z jej najbardziej powszechnych związków mają silny zapach. Dwutlenek siarki, jeden z tych związków, ma ostry, dławiący, duszący efekt na każdego, kto go wdycha. Ogień i siarka” z Biblii były jedną z najgorszych kar, jakie jej autorzy mogli sobie wyobrazić. Siarka w tym wyrażeniu odnosiła się do palącej się siarki, czyli dwutlenku siarki. Fakt, że siarka pochodzi z głębi ziemi i że dwutlenek siarki można wyczuć w wyziewach wulkanów, dodatkowo podsycał wyobrażenia ludzi o tym, jak musi wyglądać piekło.
Drugim związkiem siarki o nieprzyjemnym zapachu jest siarkowodór. Silny zapach zgniłych jaj jest spowodowany obecnością tego związku.
Występowanie i przygotowanie. Siarka jest szesnastym najobficiej występującym pierwiastkiem w skorupie ziemskiej. Występuje zarówno jako pierwiastek, jak i w różnych związkach. Jako pierwiastek można ją znaleźć w bardzo dużych, podziemnych kopalniach, najczęściej wzdłuż wybrzeża Zatoki Perskiej w Stanach Zjednoczonych oraz w Polsce i na Sycylii. Siarka jest wydobywana z tych kopalni za pomocą procesu Frascha. W procesie tym, przegrzana para wodna jest pompowana przez najbardziej zewnętrzną z trzech rur. Do wewnętrznej rury wtłaczane jest sprężone powietrze. Przegrzana para powoduje stopienie podziemnej siarki, a sprężone powietrze kieruje ją w górę, przez środkową z trzech rur, na powierzchnię Ziemi.
Siarka jest również szeroko rozpowszechniona w postaci minerałów i rud. Wiele z nich występuje w postaci siarczanów, w tym gips (siarczan wapnia, CaSO 4 ), baryt (siarczan baru, BaSO 4 ) i sole gorzkie (siarczan magnezu, MgSO 4 ). Inne są siarczkami metali, w tym pirytów żelazowych (siarczek żelaza, FeS 2 ), galeny (siarczek ołowiu, PbS), cynobru (siarczek rtęci, HgS), stibnitu (siarczek antymonu, Sb 2 S 3 ) i blendy cynkowej (siarczek cynku, ZnS). Siarka jest odzyskiwana z tych rud metali poprzez ich silne ogrzewanie w powietrzu, co powoduje przekształcenie siarki w dwutlenek siarki i uwolnienie czystego metalu. Następnie dwutlenek siarki może trafić bezpośrednio do produkcji kwasu siarkowego, na którym kończy się ponad 90 procent wydobywanej na świecie siarki.
Zastosowania siarki i jej związków. Część siarki jest używana bezpośrednio jako środek grzybobójczy i owadobójczy, w zapałkach, fajerwerkach i prochu strzelniczym oraz w wulkanizacji kauczuku naturalnego (obróbka, która nadaje kauczukowi elastyczność i wytrzymałość). Większość, jednakże, jest przekształcana w wiele użytecznych związków.
Kwas siarkowy jest zdecydowanie najważniejszym ze wszystkich związków siarki. Prawie 90 procent całej produkowanej siarki jest przekształcane najpierw w dwutlenek siarki, a następnie w kwas siarkowy. Kwas ten niezmiennie zajmuje pierwsze miejsce wśród chemikaliów produkowanych w Stanach Zjednoczonych. W 1990 roku wyprodukowano ponad 40 miliardów kilogramów (89 miliardów funtów) kwasu siarkowego, czyli o ponad 50 procent więcej niż drugiego najpopularniejszego środka chemicznego (azotu gazowego). Kwas siarkowy jest używany do produkcji nawozów, akumulatorów samochodowych, produktów naftowych, pigmentów, żelaza i stali oraz wielu innych produktów.
Obieg siarki. Podobnie jak azot, węgiel i fosfor, siarka przechodzi przez gazowe, ciekłe i stałe części naszej planety w serii ciągłych reakcji znanych jako cykl siarkowy. Główne etapy cyklu siarkowego przedstawiono na załączonej ilustracji.
Siarka jest produkowana naturalnie w wyniku erupcji wulkanicznych i emisji z gorących źródeł. Do atmosfery dostaje się głównie w postaci dwutlenku siarki, a następnie pozostaje w niej w tej postaci lub, po reakcji z wodą, w postaci kwasu siarkowego. Siarka jest przenoszona z powrotem na powierzchnię Ziemi w postaci kwaśnej depozycji podczas opadów deszczu lub śniegu.
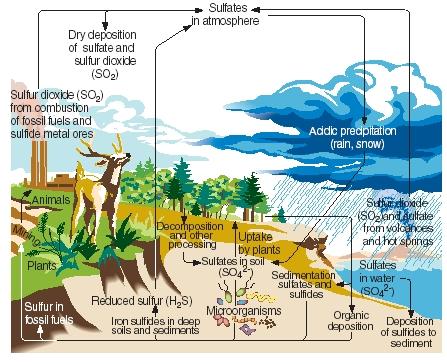
.)
Na powierzchni Ziemi dwutlenek siarki i kwas siarkowy reagują z metalami, tworząc siarczany i siarczki. Pierwiastek ten jest również włączany przez rośliny w formie znanej jako siarka organiczna. Niektóre aminokwasy, związki, z których zbudowane są białka, zawierają siarkę. Siarka organiczna pochodząca z roślin jest ostatecznie przekazywana zwierzętom, które żywią się tymi roślinami. Jest ona z kolei przekształcana z białek roślinnych w białka zwierzęce.
Kiedy rośliny i zwierzęta umierają, siarka wraca do gleby, gdzie jest przekształcana przez mikroorganizmy w siarkowodór. Gazowy siarkowodór jest następnie zwracany do atmosfery, gdzie utlenia się do kwasu siarkowego.
Działalność człowieka wpływa na cykl siarki na wiele sposobów. Na przykład, gdy węgiel i rudy metali są wydobywane, siarka i siarczki mogą być uwalniane i zwracane do gleby. Również spalanie węgla, ropy naftowej i gazu ziemnego często uwalnia dwutlenek siarki do atmosfery. Ten dwutlenek siarki jest dodawany do ilości już obecnych z naturalnych źródeł, znacznie zwiększając ilość kwaśnych opadów, które spadają na powierzchnię Ziemi. Niektórzy ludzie wierzą, że kwaśne opady (lub kwaśne deszcze) są odpowiedzialne za śmierć drzew i innych roślin, zakwaszenie jezior, które zaszkodziło zwierzętom morskim, uszkodzenie metalowych i kamiennych konstrukcji oraz inne szkody środowiskowe.
Selen, tellur i polon
Selen i tellur są stosunkowo rzadkimi pierwiastkami. Znajdują się one w dolnej dziesiątce procent wszystkich pierwiastków pod względem liczebności. Mają tendencję do występowania w skorupie ziemskiej w połączeniu z rudami miedzi i innych metali. Oba są otrzymywane jako produkt uboczny elektrolitycznej rafinacji miedzi. Podczas tego procesu opadają one na dno zbiornika elektrolizy, gdzie mogą być usunięte z powstającego osadu.
Selen występuje w różnych formach alotropowych (fizycznie lub chemicznie różne formy tej samej substancji), z których najczęstszą jest czerwony proszek, który staje się czarny pod wpływem powietrza. Temperatura topnienia tego pierwiastka wynosi 217°C (423°F), a jego temperatura wrzenia 685°C (1265°F). Tellur jest srebrzystobiałym ciałem stałym, które wygląda jak metal (choć w rzeczywistości jest metaloidem). Jego temperatura topnienia to 450°C (842°F), a temperatura wrzenia to 990°C (1,814°F).
Selen ma interesującą rolę w organizmach żywych. Jest niezbędny w bardzo niskich stężeniach do utrzymania zdrowia u większości zwierząt. W rzeczywistości jest on często dodawany do pasz dla zwierząt. Jednak w wyższych stężeniach pierwiastek ten może mieć szkodliwy wpływ na zwierzęta, powodując deformacje młodych i choroby u dorosłych.
Pierwotne zastosowania selenu to elektronika i produkcja szkła kolorowego. Maszyny fotokopiujące, ogniwa słoneczne, fotokomórki, telewizyjne lampy obrazowe oraz elektroniczne prostowniki i przekaźniki (używane do kontroli przepływu prądu elektrycznego) wszystkie wykorzystują selen. Niektóre z najpiękniejszych kolorowych szkieł, od bladego różu do wspaniałych czerwieni, są wykonane z wykorzystaniem związków selenu.
Niewielkie ilości telluru są również wykorzystywane w produkcji szkła kolorowego. Ponad 90 procent tego pierwiastka jest jednak wykorzystywane do produkcji stopów żelaza i innych metali.
Polon ma 27 izotopów, z których wszystkie są radioaktywne. Występuje naturalnie w rudach uranu, gdzie jest produktem końcowym w długiej serii reakcji, w których uran ulega rozpadowi promieniotwórczemu. Jest to jeden z najrzadszych pierwiastków na Ziemi, występujący w ilości nie większej niż około 3 × 10 -10 części na milion. Odkrycie polonu w 1898 r. przez polsko-francuską chemiczkę Marię Curie (1867-1934) jest jedną z najbardziej dramatycznych historii w dziejach nauki. Przetworzyła ona tony rudy uranu, aby uzyskać kilka miligramów nowego pierwiastka, który następnie nazwała na cześć swojej ojczyzny, Polski. Polon znajduje ograniczone zastosowanie w wysoko wyspecjalizowanych urządzeniach generujących energię, takich jak te używane w satelitach kosmicznych i sondach kosmicznych.