UTI – czy tradycyjne badania kulturowe są przestarzałe?
Data publikacji: Marzec 2020
Infekcje dróg moczowych są najczęstszym rodzajem zakażenia bakteryjnego,1 co stanowi co najmniej 11 milionów wizyt w gabinecie lekarskim, 2 do 3 milionów wizyt na oddziale ratunkowym, 400 000 hospitalizacji i około 2,3 miliarda dolarów kosztów opieki zdrowotnej rocznie w Stanach Zjednoczonych.2,3,4,5 o ogromne obciążenie dla pacjentów i systemu opieki zdrowotnej wciąż rośnie – na przykład trendy starzenia się populacji i rozprzestrzeniania się bakterii opornych na środki przeciwdrobnoustrojowe zwiększają zapotrzebowanie na intensywną terapię i śmiertelność wewnątrzszpitalną z powodu zakażeń układu moczowego.6,7
Te czynniki zwiększają potrzebę diagnozowania zakażeń układu moczowego i optymalizacji terapii przeciwdrobnoustrojowej w sposób skuteczny i dokładny. Jednakże nowe metody badawcze i coraz lepsze zrozumienie mikrobiomu układu moczowego nasuwają pytania o zasadność stosowania tradycyjnego posiewu moczu. W tym artykule omawiam główne rodzaje zakażeń układu moczowego, aktualne podejście do stosowania posiewu moczu i badania wrażliwości, najnowsze dowody dotyczące mikrobiomu układu moczowego, nowe, dostępne na rynku testy oraz przyszłe podejścia do wykrywania zakażeń układu moczowego, w tym nowe biomarkery i algorytmy uczenia maszynowego.
Niepowikłane i powikłane zakażenia układu moczowego
Rozróżnienie niepowikłanych i powikłanych zakażeń układu moczowego jest pierwszym istotnym krokiem w prowadzeniu postępowania. Niepowikłane zakażenia dróg moczowych są jednym z najczęściej leczonych rodzajów zakażeń w warunkach podstawowej opieki zdrowotnej. Kobiety są najbardziej narażone na ryzyko, z częstością występowania sięgającą 50% w ciągu całego życia i około 33% częstością nawrotów.8
Większość pacjentów z niepowikłanym zakażeniem układu moczowego to kobiety przed menopauzą, które nie są w ciąży i mają niewiele lub nie mają żadnych chorób współistniejących. Pacjenci ci zazwyczaj zgłaszają się z objawami zapalenia pęcherza moczowego, takimi jak dysuria, częstomocz i parcia naglące.9 Ból nadłonowy i krwiomocz są rzadkie, a odmiedniczkowe zapalenie nerek nie występuje. owikłane zakażenia układu moczowego dotykają zwykle pacjentów obu płci, u których występują strukturalne lub czynnościowe nieprawidłowości dróg moczowych.9 Pacjenci ci często mieli wcześniej wykonywane zabiegi urologiczne, niedawną ekspozycję na antybiotyki, niedawne lub długotrwałe cewnikowanie, niedawną lub aktualną hospitalizację (szpitalne zakażenia układu moczowego). Inne grupy wysokiego ryzyka to kobiety w ciąży, pacjenci z cukrzycą i pacjenci z innymi stanami obniżonej odporności.
Pacjenci z powikłanymi zakażeniami dróg moczowych zazwyczaj zgłaszają się z objawami odmiedniczkowego zapalenia nerek, w tym gorączką, dreszczami i bólem w dole brzucha, z lub bez nudności. Mogą mieć potwierdzoną lub podejrzewaną infekcję (infekcje) bardziej zjadliwymi bakteriami w wywiadzie. Posiew moczu może ujawnić zróżnicowaną mikrobiotę i ponadprzeciętne wzorce oporności na środki przeciwdrobnoustrojowe. Niestety, oba te czynniki mogą osłabić skuteczność terapii przeciwdrobnoustrojowej.
Kiedy rozważyć posiew moczu i jego czułość
W przeszłości złotym standardem diagnostycznym zakażeń dróg moczowych było wykonanie standardowego posiewu moczu (tzn. rozprowadzenie 1 mikrolitra moczu ze środkowego strumienia na 5% agar z krwią baranią i McConkey’a i inkubacja w warunkach tlenowych).1 W tym kontekście zakażenie układu moczowego definiowano jako obecność wyizolowanego, znanego uropatogenu w stężeniu >105 CFU/ml lub >102 CFU/ml u pacjenta z objawami. Biorąc pod uwagę dużą częstość występowania zakażeń układu moczowego oraz fakt, że posiew moczu nie jest badaniem wykonywanym w miejscu opieki, warto zastanowić się, kiedy można zrezygnować z posiewu bez pogorszenia wyników leczenia. ktualne wytyczne Infectious Diseases Society of America (IDSA) nie zalecają rutynowego wykonywania standardowego posiewu moczu u pacjentów, u których podejrzewa się niepowikłane zakażenia układu moczowego.10 Istnieją istotne dowody na to, że badanie moczu jest w tym przypadku miarodajne. W jednym z badań około 94% pacjentów z ujemnym wynikiem badania moczu miało również ujemny wynik posiewu.11 W podłużnym retrospektywnym badaniu obejmującym prawie 21 000 pacjentek ambulatoryjnych, ujemny wynik badania moczu był związany z 2,5-krotnie większym prawdopodobieństwem ujemnego wyniku posiewu (<103 CFU/ml) w porównaniu z dodatnim wynikiem badania moczu.12 U pacjentek z nawracającymi objawami zakażenia dróg moczowych wcześniejsze ujemne wyniki badania moczu lub posiewu moczu albo obecne podrażnienie lub upławy z pochwy wiązały się z istotnym statystycznie zwiększeniem prawdopodobieństwa ujemnego wyniku posiewu. steraza leukocytów jest szczególnie przydatna przy ocenie podejrzenia niepowikłanego zakażenia dróg moczowych. W dużym retrospektywnym badaniu ponad 8 500 takich pacjentów, ujemny wynik oznaczenia esterazy leukocytów przewidywał ujemny wynik posiewu moczu z 95% dokładnością (ujemna wartość predykcyjna, 0,95), podczas gdy ujemne wyniki zarówno dla esterazy leukocytów jak i azotanów były tylko nieznacznie dokładniejsze (łączna ujemna wartość predykcyjna, 0,96).13 Należy zauważyć, że ujemny wynik samego azotanu był znacznie mniej wiarygodny w przewidywaniu ujemnego wyniku posiewu (ujemna wartość predykcyjna, 0,87).
W przypadku pacjentów z niepowikłanymi zakażeniami dróg moczowych wytyczne IDSA zalecają wybór jednego z następujących leków do empirycznej terapii przeciwdrobnoustrojowej:10
– Nitrofurantoina 100mg dwa razy dziennie (BID) przez 5 dni
– Trimetoprim/sulfametoksazol (Bactrim DS) przez 3 dni, jeśli lokalne wskaźniki oporności wynoszą <20% (jeśli nie masz jeszcze dostępu do tych danych, rozważ kontakt z lokalnymi, powiatowymi lub stanowymi departamentami zdrowia).
– Fosfomycyna (pojedyncza dawka 3 g)
– Należy pamiętać, że fluorochinolony, takie jak ciprofloksacyna, nie są już zalecane w niepowikłanych zakażeniach układu moczowego ze względu na wysoki wskaźnik oporności w niektórych obszarach
Dodatkowo, wybór terapii przeciwdrobnoustrojowej w niepowikłanych zakażeniach układu moczowego powinien być podyktowany lokalnymi wzorcami oporności na środki przeciwdrobnoustrojowe oraz najlepszym, świadomym przypuszczeniem klinicysty co do najbardziej prawdopodobnego uropatogenu. W badaniu obejmującym ponad 9000 kobiet z niepowikłanymi zakażeniami układu moczowego potwierdzonymi w hodowli, 19% izolatów było opornych na trimetoprim-sulfametoksazol i 12% na nitrofurantoinę (10% było opornych na ciprofloksacynę, która nie jest już zalecana w leczeniu empirycznym).14 Istotnymi czynnikami predykcyjnymi oporności na środki przeciwdrobnoustrojowe było zamieszkiwanie w rejonie ZIP o ponadprzeciętnych wskaźnikach oporności na środki przeciwdrobnoustrojowe, przebyte zakażenie opornym uropatogenem lub przepisanie terapii przeciwdrobnoustrojowej w ciągu ostatnich 2 lat. W oparciu o te dane badacze opracowali algorytm, który wybrał odpowiednią terapię przeciwdrobnoustrojową w 92% przypadków, przewyższając wskaźnik wyboru dokonanego przez świadczeniodawcę, który wynosił 87,5%.
W podsumowaniu, u pacjentów z niepowikłanymi zakażeniami dróg moczowych tradycyjny posiew moczu nie jest przestarzały, ale w większości przypadków jest zbędny.
W przypadku pacjentów podejrzanych o powikłane zakażenia układu moczowego, klinicyści powinni wybrać wstępne (empiryczne) leczenie przeciwdrobnoustrojowe w oparciu o historyczne dane dotyczące hodowli i wrażliwości, jeśli są dostępne, w uzupełnieniu do aktualnych wyników badania moczu i lokalnych wzorców oporności na środki przeciwdrobnoustrojowe. Jeśli wynik badania moczu jest ujemny, a w przeszłości pacjent miał ujemny posiew, to według ostatnich danych istnieje 87% prawdopodobieństwo, że obecne objawy nie są spowodowane zakażeniem układu moczowego.12 Takich pacjentów należy ocenić pod kątem innych przyczyn objawów, takich jak przewlekły zespół bólowy miednicy mniejszej (CPPS) lub nowotwory układu moczowego. Jeśli wynik badania moczu jest dodatni, zalecam leczenie empiryczne i zlecenie wykonania posiewu i oznaczenia czułości moczu, aby w razie potrzeby zmodyfikować leczenie.
Mocz nie jest jałowy
Do niedawna paradygmatem postępowania zarówno w niepowikłanych, jak i powikłanych zakażeniach było eliminowanie drobnoustrojów z dróg moczowych. Obecnie eksperci uznają, że takie podejście jest ograniczone przez dwa kluczowe czynniki: mikrobiota jest obecna w bezobjawowych (zdrowych) drogach moczowych, a standardowa hodowla jest stosunkowo mało czuła w wykrywaniu mikroorganizmów w moczu. jednym z ostatnich badań naukowcy przeprowadzili ilościową PCR 16S rybosomalnego RNA z 16 próbek moczu od zdrowych mężczyzn i kobiet w wieku od 26 do 90 lat.16 Pięć próbek wykazało pozytywny wynik dla jednego rodzaju bakterii i od jednego do sześciu rodzajów, podczas gdy pozostałe zawierały średnio pięć rodzajów i od ośmiu do 36 rodzajów. W innym badaniu naukowcy przeprowadzili wysokowydajne sekwencjonowanie PCR próbek moczu od ośmiu kobiet, z których wszystkie miały ujemne standardowe posiewy moczu.17 Wszystkie próbki były polimikrobowe i wykazywały znaczną zmienność międzyosobniczą: zidentyfikowano 45 unikalnych gatunków bakterii, z których dziewięć było związanych z infekcjami dróg moczowych, a 20 miało nieznany potencjał patogenny. Podobne badania potwierdziły to odkrycie,18 sugerując, że mocz od zdrowych osób często zawiera bakterie, których standardowe posiewy moczu nie wykrywają.
W innym badaniu zagłębiono się bardziej, stosując rozszerzoną ilościową hodowlę moczu (EQUC) w celu określenia, czy bakterie zidentyfikowane w próbkach moczu były żywotne.19 Metoda ta polega na posiewaniu większych objętości moczu, inkubacji próbek w szerszym zakresie warunków wzrostu i stosowaniu dłuższych okresów inkubacji. Spośród 65 próbek moczu ocenionych przez EQUC, 80% wyhodowało bakterie, z których 92% nie zostało wykrytych przez standardową hodowlę. Zidentyfikowano 35 rodzajów bakterii, z których najczęściej występowały Lactobacillus, Corynebacterium, Streptococcus, Actinomyces i Staphylococcus. Większość gatunków bakterii replikowała się do liczby poniżej progu wykrywalności w standardowych protokołach hodowli moczu. Wyniki te zostały potwierdzone w innym, niedawno przeprowadzonym badaniu z udziałem 150 dorosłych (połowa zgłaszała objawy ze strony układu moczowego), w którym przy użyciu EQUC wykryto 182 uropatogeny – trzykrotnie więcej niż w standardowej hodowli.20
Wyniki tych badań łącznie potwierdzają, że zróżnicowana mikrobiota moczowa jest obecna zarówno u osób zdrowych, jak i u pacjentów z objawami ze strony układu moczowego, oraz że standardowe metody hodowli moczu są stosunkowo mało czułe w charakteryzowaniu tego mikrobiomu, w tym uropatogenów. Standardowe hodowle nie symulują również w sposób wiarygodny biofilmów, takich jak te tworzone w cewnikach moczowych, a ostateczne wyniki standardowych hodowli i oznaczeń wrażliwości wymagają kilku dni, aby zostały podane.11,21 Trzy dostępne na rynku testy do badania moczu wykrywają uropatogeny z większą czułością niż standardowa hodowla moczu, a także szybko wykrywają dowody oporności na środki przeciwdrobnoustrojowe (Tabela 1).18,19,22 Potencjalne korzyści z tych testów obejmują szybszą identyfikację patogenów, dokładniejsze wyniki czułości i zindywidualizowane leczenie, co teoretycznie może poprawić wyniki pacjentów.23,24,25
Test Vikor Urine-ID™ jest testem opartym na metodzie PCR, który jest w stanie wykryć wiele gatunków bakterii, a także zidentyfikować do 30 genów bakteryjnych kodujących oporność na środki przeciwdrobnoustrojowe.26 Wyniki testu są dostępne w ciągu około 12 do 24 godzin (Tabela 1). Wraz z wynikami testu producent dostarcza informacje o regionalnych wzorcach wrażliwości na środki przeciwdrobnoustrojowe, spektrach aktywności antybiotyków, kosztach leków i odpowiednich wytycznych Amerykańskiej Agencji ds. icroGenDX UTI Urinalysis Kit jest testem dwuetapowym.27 Po pierwsze, ilościowy PCR jest wykorzystywany do badania przesiewowego w kierunku 16 rodzajów bakterii, jak również Candida albicans, a wyniki są dostarczane w ciągu 24 godzin. Po drugie, sekwencjonowanie następnej generacji (NGS) jest wykorzystywane do porównania DNA mikrobioty z próbki moczu z bazą danych ponad 30 000 gatunków drobnoustrojów, z wynikami w ciągu 3 do 5 dni (Tabela 1). Według producenta, UTI Urinalysis Kit identyfikuje wszystkie drobnoustroje w próbce moczu z dokładnością 99,9%.
Tabela 1. Przegląd nowych dostępnych na rynku testów do badania zakażeń dróg moczowych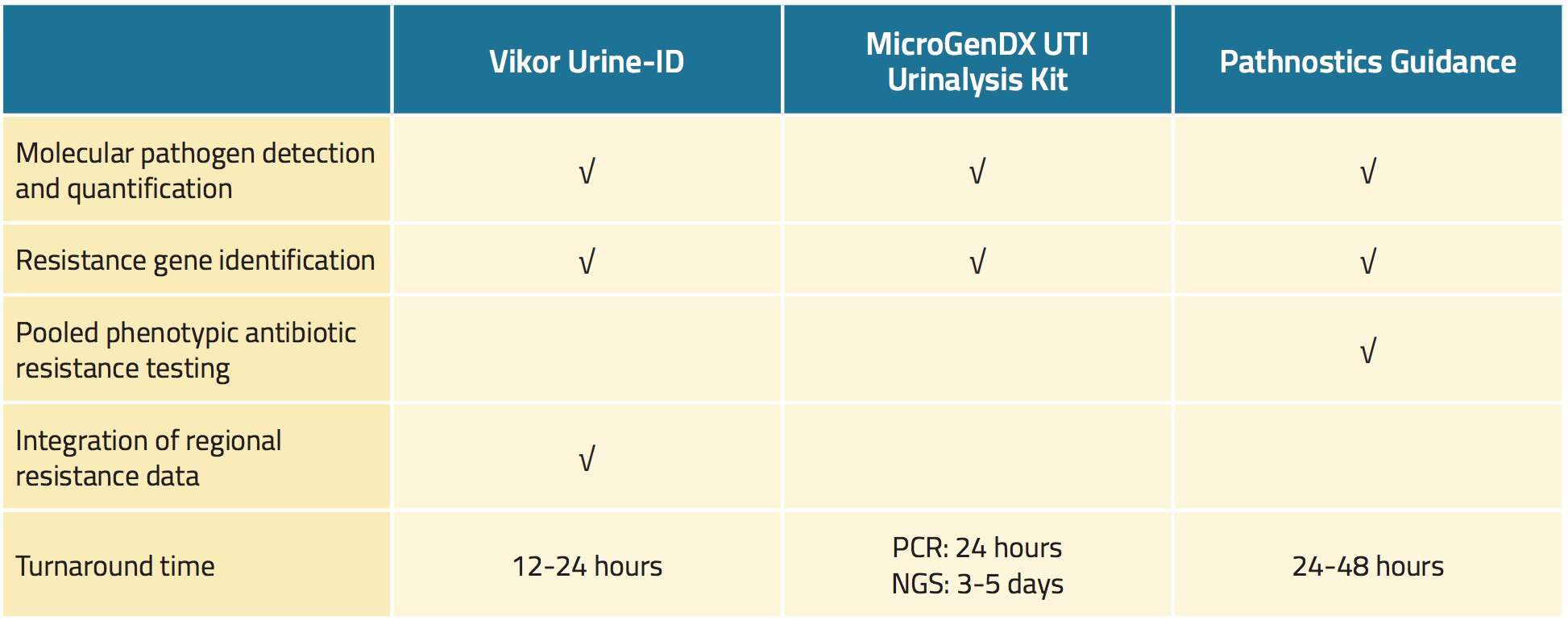
Test Pathnostics Guidance składa się z zestawu nowych testów do badania moczu dla pacjentów z zapaleniem gruczołu krokowego, śródmiąższowym zapaleniem pęcherza moczowego i nawracającymi zakażeniami dróg moczowych.28 Test do badania zakażeń dróg moczowych wykorzystuje PCR do badania przesiewowego na obecność 45 patogenów i 38 genów oporności. Badanie Pathnostics Guidance generuje również dane fenotypowe i zbiorcze wyniki wrażliwości na środki przeciwdrobnoustrojowe. W teście można wykorzystać mocz pobrany z cewnika lub z kału, który można przechowywać w temperaturze pokojowej przez okres do 5 dni. Wyniki są dostępne w ciągu 24 do 28 godzin.
Jedno zastrzeżenie wymaga wzmianki. Jak już mówiliśmy, te wysoce czułe testy mogą wykryć bakterie w moczu osób bezobjawowych i osób, których objawy nie są związane z infekcjami dróg moczowych. Dlatego też klinicyści nie powinni opierać swoich decyzji dotyczących leczenia wyłącznie na wynikach testów. Takie postępowanie może mieć niekorzystne konsekwencje dla pacjentów. W jednym z badań z udziałem 673 kobiet w młodym i średnim wieku z bezobjawową bakteriurią i wywiadem nawracających zakażeń układu moczowego, połowa pacjentów otrzymała leczenie przeciwdrobnoustrojowe, podczas gdy pozostali nie otrzymali takiego leczenia.22 Podczas 6- i 12-miesięcznej obserwacji leczenie przeciwdrobnoustrojowe wiązało się z istotnym statystycznie wzrostem częstości nawrotów objawów ze strony układu moczowego. Aby uniknąć nadużywania środków przeciwdrobnoustrojowych i związanych z tym działań niepożądanych, kosztów i selekcji w kierunku oporności na środki przeciwdrobnoustrojowe, ważne jest, aby klinicyści oceniali wyniki badań w kontekście ogólnego ryzyka i historii zakażeń dróg moczowych u pacjentów oraz aktualnego obrazu klinicznego.awet jeśli ostatnio zatwierdzone testy są w stanie znacznie poprawić wykrywanie i leczenie infekcji dróg moczowych w porównaniu ze standardową hodowlą, badacze nadal poszukują sposobów poprawy diagnostyki, wykrywania patogenów, ilościowej oceny wrażliwości na środki przeciwdrobnoustrojowe i algorytmów leczenia. Przykłady obejmują wykorzystanie technik uczenia maszynowego, złożonych analiz nowych biomarkerów oraz testów na sygnatury białek komórkowych. lgorytmy uczenia maszynowego okazały się obiecujące w zakresie poprawy wykrywania i oceny pacjentów z niepowikłanymi infekcjami dróg moczowych. Na przykład, w jednym z badań oceniono 17 zmiennych klinicznych i 42 zmienne immunologiczne w celu zidentyfikowania najlepszych predyktorów wyników posiewu moczu. Zmętnienie moczu było najlepszym klinicznym wskaźnikiem predykcyjnym, z pozytywną wartością predykcyjną 0,65 (co oznacza, że obecność zmętnienia moczu identyfikuje próbkę dodatnią z 65% dokładnością) i negatywną wartością predykcyjną 0.79 (co oznacza, że brak zmętnienia moczu identyfikuje próbkę hodowlaną z 79% dokładnością).29 Tak więc, zmętnienie moczu było stosunkowo mało czułe, ale wykazywało rozsądną swoistość w wykrywaniu próbki hodowlanej dodatniej. Razem, cztery biomarkery moczu – metalopeptydaza macierzy 9, lipokalina związana z żelatynazą neutrofilów, interleukina (IL)-8 i IL-1β – osiągnęły znacznie wyższą pozytywną wartość predykcyjną wynoszącą 0,82 i porównywalną negatywną wartość predykcyjną wynoszącą 0,76. Chociaż połączenie tych czterech biomarkerów moczu ze zmętnieniem moczu nie poprawiło tych wartości predykcyjnych, wyniki badania wskazały, że algorytmy uczenia maszynowego mogą wiarygodnie zidentyfikować większość pacjentów z niepowikłanymi zakażeniami dróg moczowych.29
Jeśli modele uczenia maszynowego staną się bardziej wyrafinowane, ich wartości predykcyjne mogą ulec poprawie, co może przyczynić się do dalszej poprawy diagnostyki i leczenia zakażeń dróg moczowych w narażonych populacjach, przy jednoczesnym zmniejszeniu obciążenia pracą diagnostyczną. Na przykład, w ostatnim dużym badaniu przeanalizowano ponad 212 000 raportów wyników mikroskopii moczu, posiewu i czułości z trzech szpitali i przychodni w Wielkiej Brytanii.30 Specjalne algorytmy uczenia maszynowego zostały zaprojektowane dla podgrup wysokiego ryzyka, takich jak kobiety w ciąży, dzieci i osoby z uporczywymi lub nawracającymi infekcjami dróg moczowych. Uczenie maszynowe pozwoliło wykryć około 95% próbek dodatnich na posiew, zmniejszając jednocześnie nakład pracy związany z posiewem moczu o około 41% i osiągając około 24% wyższą swoistość niż model heurystyczny oparty na liczbie białych krwinek i bakterii. Wyniki te są szczególnie godne uwagi w czasach, gdy starzenie się populacji i pojawienie się bakterii opornych na środki przeciwdrobnoustrojowe zwiększa potrzebę skutecznego i dokładnego wykrywania infekcji dróg moczowych, które wymagają leczenia. awracające zakażenia układu moczowego (historycznie definiowane jako co najmniej dwa zakażenia układu moczowego w ciągu ostatnich 6 miesięcy lub więcej niż trzy zakażenia w ciągu ostatniego roku) występują u około 50% kobiet w wieku powyżej 55 lat i u 27% młodszych kobiet.31, 32 Aktualne wytyczne wymagają intensywnego postępowania z zastosowaniem takich środków, jak profilaktyczne leczenie przeciwbakteryjne, ograniczenie stosowania środków plemnikobójczych, oddawanie moczu po stosunku, profilaktyka immunologiczna z użyciem OM-89, szczepienia dopochwowe z użyciem Urovacu oraz stosowanie kremów lub pierścieni z estrogenami dopochwowymi u kobiet po porodzie.31, 33 Analiza biomarkerów surowicy i moczu może pomóc w lepszym przewidywaniu, u których pacjentek wystąpią nawracające zakażenia dróg moczowych, tak aby można było u nich wcześniej zastosować ukierunkowaną interwencję.32 Istotne biomarkery nawracających zakażeń układu moczowego obejmują zmniejszone stężenie witaminy D i antygenu specyficznego dla prostaty w surowicy, zwiększone stężenie immunoglobulin, czynnika stymulującego tworzenie kolonii granulocytów, czynnika stymulującego tworzenie kolonii makrofagów i IL-5, podczas gdy istotne biomarkery moczu obejmują zwiększone stężenie IL-8 i zmniejszone stężenie czynnika wzrostu nerwów i lipokaliny związanej z żelatynazą neutrofilów.
Przyszła diagnostyka może również obejmować testy biomarkerów w punktach opieki, które uzupełniają lub zmniejszają potrzebę posiewów moczu. Idealny test byłby równie szybki i niedrogi jak badanie bagnetowe moczu, ale bardziej precyzyjny i dokładny. Potencjalni kandydaci to trimetyloamina i octan, które są markerami metabolizmu bakterii oraz oksydaza ksantynowa i mieloperoksydaza, które są biomarkerami enzymatycznymi.34
Przyszłe badania mogą również oceniać egzosom moczu jako potencjalny biomarker infekcji dróg moczowych. Egzosom składa się z małych pęcherzyków pozakomórkowych, które przenoszą białka komórkowe. W jednym z badań białka Akt (wewnątrzkomórkowe białko sygnałowe) i CD9 (wewnątrzkomórkowe białko transmembranowe) były znacząco podwyższone u kobiet z infekcjami dróg moczowych w porównaniu z kobietami z bezobjawową bakteriurią, a poziomy obu białek znacząco spadły po zastosowaniu terapii antybakteryjnej.35 Wyniki takich badań mogą kiedyś ułatwić rozwój komercyjnych testów oceniających egzosomy moczu, aby pomóc w podejmowaniu decyzji dotyczących leczenia.
Podsumowanie
Ocena i leczenie zakażeń dróg moczowych jest integralną częścią praktyki urologicznej. W przypadku niepowikłanych zakażeń dróg moczowych posiew moczu jest zazwyczaj zbędny, a leczenie empiryczne zgodne z aktualnymi wytycznymi IDSA jest właściwe. Leczenie empiryczne oparte na historycznych wynikach hodowli i czułości jest również właściwe w powikłanych zakażeniach dróg moczowych, ale powinno być modyfikowane w oparciu o aktualną hodowlę i czułość. Nawracające infekcje dróg moczowych mogą wymagać intensywnych interwencji terapeutycznych i behawioralnych. hociaż są to nasze obecne najlepsze praktyki, pozostawiają one wiele miejsca na poprawę, szczególnie biorąc pod uwagę ostatnie dowody na istnienie mikrobiomu układu moczowego i ograniczenia standardowych badań przesiewowych i hodowli. Istnieje zapotrzebowanie na szybkie, wiarygodne testy, które pozwolą lepiej wykrywać uropatogeny, odróżniać klinicznie istotną dysbiozę układu moczowego od klinicznie nieistotnej bakteriurii i kierować terapią przeciwdrobnoustrojową w oparciu o spersonalizowane dane dotyczące oporności. Obecnie dostępne są oznaczenia czułości oparte na ilościowym PCR i sekwencjonowaniu następnej generacji. W przyszłości, zastosowanie ulepszonych metod ilościowych posiewu moczu może również poprawić opiekę kliniczną. Badacze oceniają również algorytmy uczenia maszynowego, które uwzględniają biomarkery surowicy i moczu oraz inne zmienne kliniczne w celu skuteczniejszego wykrywania zakażeń dróg moczowych, przewidywania nawrotów i zmniejszenia obciążenia diagnostycznego. Połączenie tych nowych metod z danymi dotyczącymi lokalnej oporności i readmisji do szpitala może zwiększyć ich użyteczność. Celem końcowym jest opracowanie czułych, specyficznych, opłacalnych testów i praktycznych algorytmów, które poprawią zarządzanie i wyniki leczenia pacjentów.
Written by: Edward Schaeffer, MD, Ph.D., Chair, Department of Urology, Feinberg School of Medicine, Program Director, Genitourinary Oncology Program, Robert H. Lurie Comprehensive Cancer Center, Northwestern University, Chicago, Illinois
1. Schaeffer, AJ., Matulewicz, RS., & Klumpp, DJ. (2016). Zakażenia układu moczowego. In AJ. Wein, & et al (Eds.), Campbell-Walsh Urology, Eleventh Edition Philadelphia: Elsevier-Saunders.
2. Schappert, S. M., and E. A. Rechtsteiner. „Szacunki wykorzystania ambulatoryjnej opieki medycznej w 2007 roku”. Vital and Health Statistics. Series 13, Data from the National Health Survey 169 (2011): 1-38.
3. Foxman, Betsy. „Zespoły zakażeń układu moczowego: występowanie, nawroty, bakteriologia, czynniki ryzyka i obciążenie chorobą.” Infectious disease clinics of North America 28, nr 1 (2013): 1-13.
4. Foxman, Betsy. „The epidemiology of urinary tract infection.” Nature Reviews Urology 7, nr 12 (2010): 653.
5. Simmering, Jacob E., Fan Tang, Joseph E. Cavanaugh, Linnea A. Polgreen, and Philip M. Polgreen. „Wzrost liczby hospitalizacji z powodu zakażeń układu moczowego i związanych z tym kosztów w Stanach Zjednoczonych, 1998-2011”. In Choroby zakaźne na otwartym forum, vol. 4, no. 1. Oxford University Press, 2017.
6. Nguyen, Hoa Q., Nga TQ Nguyen, Carmel M. Hughes, and Ciaran O’Neill. „Trends and impact of antimicrobial resistance on older inpatients with urinary tract infections (UTIs): A national retrospective observational study.” PloS one 14, nr 10 (2019).
7. Critchley, Ian A., Nicole Cotroneo, Michael J. Pucci, and Rodrigo Mendes. „The burden of antimicrobial resistance among urinary tract isolates of Escherichia coli in the United States in 2017”. PloS one 14, no. 12 (2019).
8.Gupta, Kalpana, and Barbara W. Trautner. „Diagnosis and management of recurrent urinary tract infections in non-pregnant women.” Bmj 346 (2013): f3140.
9. Tan, Chee Wei, and Maciej Piotr Chlebicki. „Zakażenia dróg moczowych u dorosłych.” Singapore medical journal 57, no. 9 (2016): 485.
10. Gupta, Kalpana, Thomas M. Hooton, Kurt G. Naber, Björn Wullt, Richard Colgan, Loren G. Miller, Gregory J. Moran et al. „International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases.” Clinical infectious diseases 52, no. 5 (2011): e103-e120.
11. Huang, Bin, Lei Zhang, Weizheng Zhang, Kang Liao, Shihong Zhang, Zhiquan Zhang, Xingyan Ma et al. „Direct detection and identification of bacterial pathogens from urine with optimized specimen processing and enhanced testing algorithm.” Journal of clinical microbiology 55, no. 5 (2017): 1488-1495.
12. Cohen, Jason E., Emily M. Yura, Liqi Chen, and Anthony J. Schaeffer. „Predictive Utility of Prior Negative Cultures in Urine Cultures in Women with Suspected Recurrent Uncomplicated Urinary Tract Infections.” The Journal of urology 202, no. 5 (2019): 979-985.
13. Marques, Alexandre Gimenes, Jacyr Pasternak, Márcio dos Santos Damascena, Carolina Nunes França, and Marinês Dalla Valle Martino. „Wydajność przesiewowego testu bagnetowego jako predyktor ujemnego wyniku posiewu moczu”. Einstein (São Paulo) 15, nr 1 (2017): 34-39.
14. Cohen, Jason E., Liqi Chen, and Anthony J. Schaeffer. „Algorithms Using Previous Resistance, Prior Antimicrobial Prescriptions, and Patient Place of Residence Enhance Empirical Therapy for Women With Uncomplicated Urinary Tract Infections.” Urology 137 (2020): 72-78.
15. Finucane, Thomas E. „’Urinary tract infection’ and the microbiome.” The American journal of medicine 130, no. 3 (2017): e97-e98.
16. Lewis, Debbie Ann, Richard Brown, Jon Williams, Paul White, Susan Kim Jacobson, Julian Marchesi, and Marcus John Drake. „The human urinary microbiome; bacterial DNA in voided urine of asymptomatic adults”. Frontiers in cellular and infection microbiology 3 (2013): 41.
17. Siddiqui, Huma, Alexander J. Nederbragt, Karin Lagesen, Stig L. Jeansson, and Kjetill S. Jakobsen. „Assessing diversity of the female urine microbiota by high throughput sequencing of 16S rDNA amplicons.” BMC microbiology 11, no. 1 (2011): 244.
18. Wolfe, Alan J., Evelyn Toh, Noriko Shibata, Ruichen Rong, Kimberly Kenton, MaryPat FitzGerald, Elizabeth R. Mueller et al. „Evidence of uncultivated bacteria in the adult female bladder.” Journal of clinical microbiology 50, no. 4 (2012): 1376-1383.
19. Hilt, Evann E., Kathleen McKinley, Meghan M. Pearce, Amy B. Rosenfeld, Michael J. Zilliox, Elizabeth R. Mueller, Linda Brubaker, Xiaowu Gai, Alan J. Wolfe, and Paul C. Schreckenberger. „Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder.” Journal of clinical microbiology 52, no. 3 (2014): 871-876.
20. Price, Travis K., Tanaka Dune, Evann E. Hilt, Krystal J. Thomas-White, Stephanie Kliethermes, Cynthia Brincat, Linda Brubaker, Alan J. Wolfe, Elizabeth R. Mueller, and Paul C. Schreckenberger. „Kliniczny posiew moczu: udoskonalone techniki poprawiają wykrywanie istotnych klinicznie mikroorganizmów.” Journal of clinical microbiology 54, no. 5 (2016): 1216-1222.
21. Sathiananthamoorthy, Sanchutha, James Malone-Lee, Kiren Gill, Anna Tymon, Trang K. Nguyen, Shradha Gurung, Linda Collins et al. „Reassessment of routine midstream culture in diagnosis of urinary tract infection.” Journal of clinical microbiology 57, no. 3 (2019): e01452-18.
22. Cai, Tommaso, Sandra Mazzoli, Nicola Mondaini, Francesca Meacci, Gabriella Nesi, Carolina D’Elia, Gianni Malossini, Vieri Boddi, and Riccardo Bartoletti. „The role of asymptomatic bacteriuria in young women with recurrent urinary tract infections: to treat or not to treat?”. Clinical infectious diseases 55, no. 6 (2012): 771-777.
23. Lehmann, Lutz E., Stefan Hauser, Thomas Malinka, Sven Klaschik, Stefan U. Weber, Jens-Christian Schewe, Frank Stüber, and Malte Book. „Rapid qualitative urinary tract infection pathogen identification by SeptiFast® real-time PCR.” PLoS One 6, nr 2 (2011).
24. Schmidt, K., K. K. Stanley, R. Hale, L. Smith, J. Wain, J. O’grady, and D. M. Livermore. „Evaluation of multiplex tandem PCR (MT-PCR) assays for the detection of bacterial resistance genes among Enterobacteriaceae in clinical urines.” Journal of Antimicrobial Chemotherapy 74, nr 2 (2019): 349-356.
25. Barczak, Amy K., James E. Gomez, Benjamin B. Kaufmann, Ella R. Hinson, Lisa Cosimi, Mark L. Borowsky, Andrew B. Onderdonk et al. „RNA signatures allow rapid identification of pathogens and antibiotic susceptibilities.” Proceedings of the national academy of sciences 109, no. 16 (2012): 6217-6222.
26. Urine-IDTM – Vikor Scientific. https://www.vikorscientific.com/test-menu/urine-id/. Dostęp 15 lutego 2020 r.
27. UTI Urine Kit – Insurance | MicroGen Diagnostics. https://microgendx.com/product/urine-kit-ins/. Dostęp 15 lutego 2020 r.
28. Wytyczne – Pathnostics. https://www.pathnostics.com/physicians/tests/guidance/. Dostęp 15 lutego 2020 r.
29. Gadalla, Amal AH, Ida M. Friberg, Ann Kift-Morgan, Jingjing Zhang, Matthias Eberl, Nicholas Topley, Ian Weeks et al. „Identification of clinical and urine biomarkers for uncomplicated urinary tract infection using machine learning algorithms.” Scientific Reports 9, no. 1 (2019): 1-11.
30. Burton, Ross J., Mahableshwar Albur, Matthias Eberl, and Simone M. Cuff. „Using artificial intelligence to reduce diagnostic workload without compromising detection of urinary tract infections.” BMC medical informatics and decision making 19, no. 1 (2019): 171.
31. Bonkat, G., R. Pickard, R. Bartoletti, F. Bruyere, S. E. Geerlings, and F. Wagenlehner. „Wytyczne dotyczące zakażeń urologicznych. EAU Guidelines.” European Association of Urology (2017).
32. Jhang, Jia-Fong, and Hann-Chorng Kuo. „Ostatnie postępy w zakresie nawracających zakażeń układu moczowego od patogenezy i biomarkerów do profilaktyki.” Tzu-Chi Medical Journal 29, no. 3 (2017): 131.
33. Dason, Shawn, Jeyapandy T. Dason, and Anil Kapoor. „Wytyczne dotyczące diagnostyki i postępowania w nawracającym zakażeniu układu moczowego u kobiet.” Canadian Urological Association Journal 5, no. 5 (2011): 316.
34. Karlsen, H., and T. Dong. „Biomarkery zakażeń dróg moczowych: stan wiedzy i obiecujące zastosowania dla szybkich czujników chemicznych opartych na paskach”. Analytical Methods 7, no. 19 (2015): 7961-7975.
35. Mizutani, Kosuke, Kyojiro Kawakami, Kengo Horie, Yasunori Fujita, Koji Kameyama, Taku Kato, Keita Nakane et al. „Egzosomy moczu jako potencjalny biomarker infekcji dróg moczowych.” Cellular microbiology 21, no. 7 (2019): e13020.
Related Content:
Download: Everyday Urology: Volume 5, Issue 1
.