Wczesne idee dotyczące materii: From Democritus to Dalton
Modern atomic theory

Priestley, Lavoisier i inni położyli podwaliny pod dziedzinę chemii. Ich eksperymenty pokazały, że niektóre substancje mogą łączyć się z innymi, tworząc nowe materiały, inne mogą zostać rozłożone na prostsze, a kilka kluczowych „pierwiastków” nie może być dalej rozłożonych. Ale co mogłoby wyjaśnić ten złożony zestaw obserwacji? John Dalton, wyjątkowy brytyjski nauczyciel i naukowiec, poskładał wszystkie elementy w całość i w 1803 roku opracował pierwszą nowoczesną teorię atomu. Aby dowiedzieć się więcej o eksperymentach Priestleya i Lavoisiera oraz o tym, jak stały się one podstawą teorii Daltona, wypróbuj interaktywny eksperyment Dalton’s Playhouse, do którego link znajduje się poniżej.
Dalton regularnie śledził i zapisywał pogodę w swoim rodzinnym Manchesterze, w Anglii. Dzięki swoim obserwacjom porannej mgły i innych zjawisk pogodowych Dalton zdał sobie sprawę, że woda może istnieć jako gaz, który miesza się z powietrzem i zajmuje tę samą przestrzeń co powietrze. Ciała stałe nie mogą zajmować tej samej przestrzeni co inne; na przykład lód nie może mieszać się z powietrzem. Co więc mogło sprawić, że woda zachowywała się czasem jak ciało stałe, a czasem jak gaz? Dalton zdał sobie sprawę, że cała materia musi składać się z maleńkich cząsteczek. W stanie gazowym cząsteczki te swobodnie unosiły się w powietrzu i mogły mieszać się z innymi gazami, tak jak proponował Bernoulli. Dalton rozszerzył jednak tę ideę na całą materię – gazy, ciała stałe i ciecze. Dalton po raz pierwszy zaproponował część swojej teorii atomu w 1803 r., a następnie udoskonalił te koncepcje w swojej klasycznej pracy z 1808 r. zatytułowanej A New System of Chemical Philosophy (do której można uzyskać dostęp poprzez link w zakładce Resources).
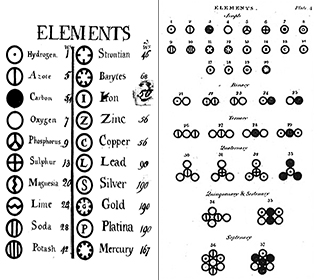
Teoria Daltona miała cztery główne koncepcje:
-
Wszystka materia składa się z niepodzielnych cząstek zwanych atomami. Bernoulli, Dalton i inni wyobrażali sobie atomy jako maleńkie cząstki przypominające kule bilardowe w różnych stanach ruchu. Chociaż ta koncepcja jest użyteczna, aby pomóc nam zrozumieć atomy, nie jest ona poprawna, jak zobaczymy w późniejszych modułach teorii atomowej, do których odnośniki znajdują się na dole tego modułu.
-
Wszystkie atomy danego pierwiastka są identyczne; atomy różnych pierwiastków mają różne właściwości. Teoria Daltona sugerowała, że każdy pojedynczy atom pierwiastka, takiego jak tlen, jest identyczny z każdym innym atomem tlenu; ponadto atomy różnych pierwiastków, takich jak tlen i rtęć, różnią się od siebie. Dalton scharakteryzował pierwiastki według ich masy atomowej; jednak gdy pod koniec XIX wieku odkryto izotopy pierwiastków, koncepcja ta uległa zmianie.
-
Reakcje chemiczne polegają na łączeniu atomów, a nie na ich niszczeniu. Atomy są niezniszczalne i niezmienne, więc związki, takie jak woda i kalks rtęciowy, powstają, gdy jeden atom łączy się chemicznie z innymi atomami. Była to niezwykle zaawansowana koncepcja jak na swoje czasy; podczas gdy teoria Daltona zakładała, że atomy łączą się ze sobą, minie ponad 100 lat, zanim naukowcy zaczną wyjaśniać koncepcję wiązania chemicznego.
-
Gdy pierwiastki reagują, tworząc związki, reagują w określonych, całkowitych proporcjach liczbowych. Eksperymenty przeprowadzone przez Daltona i innych wykazały, że reakcje nie są przypadkowe; przebiegają one według precyzyjnych i dobrze zdefiniowanych wzorów. Ta ważna koncepcja w chemii jest omówiona bardziej szczegółowo poniżej.
Punkt kontrolny zrozumienia
Pierwiastek składa się z
Niektóre szczegóły teorii atomu Daltona wymagają więcej wyjaśnień.
Elementy: Już w 1660 roku Robert Boyle uznał, że grecka definicja pierwiastka (ziemia, ogień, powietrze i woda) nie jest poprawna. Boyle zaproponował nową definicję pierwiastka jako podstawowej substancji, a obecnie definiujemy pierwiastki jako podstawowe substancje, które nie mogą być dalej rozkładane na drodze chemicznej. Pierwiastki są elementami konstrukcyjnymi wszechświata. Są to czyste substancje, które stanowią podstawę wszystkich otaczających nas materiałów. Niektóre pierwiastki można zobaczyć w czystej postaci, jak np. rtęć w termometrze; inne widzimy głównie w połączeniu chemicznym z innymi, jak np. tlen i wodór w wodzie. Obecnie znamy około 116 różnych pierwiastków. Każdy z pierwiastków ma swoją nazwę i jedno- lub dwuliterowy skrót. Często skrót ten jest po prostu pierwszą literą danego pierwiastka; na przykład wodór jest skracany jako H, a tlen jako O. Czasami pierwiastek otrzymuje dwuliterowy skrót; na przykład hel to He. Pisząc skrót nazwy pierwiastka, pierwsza litera jest zawsze wielka, a druga (jeśli jest) mała.
Atomy: Pojedyncza jednostka pierwiastka nazywana jest atomem. Atom jest najbardziej podstawową jednostką materii, z której składa się wszystko w otaczającym nas świecie. Każdy atom zachowuje wszystkie chemiczne i fizyczne właściwości swojego macierzystego pierwiastka. Pod koniec XIX wieku naukowcy wykazali, że atomy w rzeczywistości składają się z mniejszych, „subatomowych” kawałków, co rozbiło koncepcję atomu jako kuli bilardowej (zobacz nasz moduł Teoria atomu I: Wczesne dni).
Związki: Większość materiałów, z którymi się stykamy, to związki, substancje powstałe w wyniku chemicznego połączenia dwóch lub więcej atomów pierwiastków. Pojedyncza „cząsteczka” związku nazywana jest molekułą. Dalton błędnie wyobrażał sobie, że atomy „zaczepiają się” razem, tworząc cząsteczki. Dalton zdał sobie jednak sprawę, że związki mają precyzyjne wzory. Woda, na przykład, zawsze składa się z dwóch części wodoru i jednej części tlenu. Wzór chemiczny związku zapisuje się przez wymienienie symboli poszczególnych pierwiastków razem, bez żadnych odstępów między nimi. Jeśli cząsteczka zawiera więcej niż jeden atom danego pierwiastka, po symbolu wpisuje się liczbę oznaczającą liczbę atomów tego pierwiastka w cząsteczce. Tak więc wzór dla wody to H2O, nigdy HO lub H2O2.
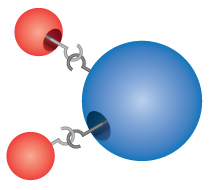
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.