Zasady biologii
Po nauczeniu się, że reakcje chemiczne uwalniają energię, gdy wiązania magazynujące energię są zerwane, ważne następne pytanie jest następujące: W jaki sposób energia związana z tymi reakcjami chemicznymi jest kwantyfikowana i wyrażana? Jak można porównać energię uwolnioną w jednej reakcji z energią uwolnioną w innej reakcji? Pomiar energii swobodnej jest używany do ilościowego określenia tych transferów energii. Przypomnijmy, że zgodnie z drugim prawem termodynamiki, wszystkie transfery energii wiążą się z utratą pewnej ilości energii w nieużytecznej formie, takiej jak ciepło. Energia swobodna odnosi się w szczególności do energii związanej z reakcją chemiczną, która jest dostępna po uwzględnieniu strat. Innymi słowy, wolna energia jest energią użyteczną lub energią, która jest dostępna do wykonania pracy. Patrząc na to pojęcie w sensie biologicznym, energia swobodna jest energią w cząsteczce, która może być użyta do wykonania pracy. Glukoza ma dużo wolnej energii, ponieważ jest dużo energii zmagazynowanej w wiązaniach cząsteczki glukozy. Dwutlenek węgla ma znacznie mniejszą energię swobodną, ponieważ w jego wiązaniach zgromadzonych jest znacznie mniej energii.
Jeśli podczas reakcji chemicznej uwalniana jest energia, to zmiana energii swobodnej wynikająca z przemiany reagentów w produkty, oznaczana jako ΔG (delta G), będzie liczbą ujemną. Ujemna zmiana energii swobodnej oznacza również, że produkty reakcji mają mniej energii swobodnej niż reaktanci, ponieważ w trakcie reakcji uwalniają pewną ilość energii swobodnej. Reakcje, które mają ujemną zmianę w energii swobodnej i w konsekwencji uwalniają energię swobodną nazywamy reakcjami egzergicznymi. Pomyśl: egzergoniczne oznacza, że energia opuszcza układ. Reakcje te są również określane jako reakcje spontaniczne, a ich produkty mają mniej zmagazynowanej energii niż reaktanty. Należy dokonać ważnego rozróżnienia pomiędzy terminem spontaniczność a ideą natychmiastowego zajścia reakcji chemicznej. W przeciwieństwie do codziennego użycia tego terminu, reakcja spontaniczna nie jest reakcją, która zachodzi nagle lub szybko. Rdzewienie żelaza jest przykładem reakcji spontanicznej, która zachodzi powoli, stopniowo, w miarę upływu czasu.
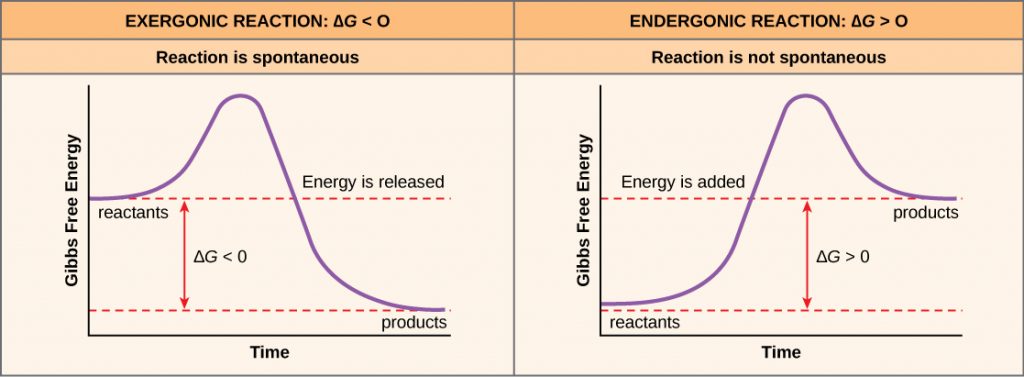
Jeśli reakcja chemiczna pochłania energię, a nie ją uwalnia, wówczas ΔG dla tej reakcji będzie miało wartość dodatnią. W tym przypadku, produkty mają więcej energii swobodnej niż reaktanci. Produkty tych reakcji mogą być zatem postrzegane jako cząsteczki magazynujące energię. Te reakcje chemiczne nazywamy reakcjami endergonicznymi i są one nie spontaniczne.
Reakcja endergoniczna nie zajdzie sama z siebie bez dodania wolnej energii.

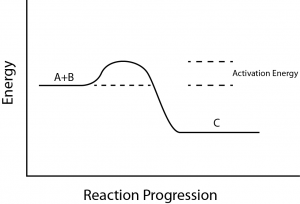
Jest jeszcze jedna ważna koncepcja, która musi być rozważona w odniesieniu do reakcji endergonicznych i egzergonicznych. Reakcje egzergoniczne wymagają niewielkiego wkładu energii, aby rozpocząć, zanim będą mogły przejść do etapu uwalniania energii.
Reakcje te mają uwalnianie energii netto, ale nadal wymagają pewnego wkładu energii na początku. Ta niewielka ilość energii konieczna do zajścia wszystkich reakcji chemicznych jest nazywana energią aktywacji (Rysunek 3).
Jeśli nie zaznaczono inaczej, obrazy na tej stronie są na licencji CC-BY 4.0 by OpenStax.
Tekst zaadaptowany z: OpenStax, Concepts of Biology. OpenStax CNX. May 18, 2016 http://cnx.org/contents/[email protected]
Tekst zaadaptowany z: OpenStax, Concepts of Biology.