10.13: Hipótese Avogadro e Volume Molar
Hipótese Avogadro e Volume Molar
Volume é uma terceira forma de medir a quantidade de matéria, após a contagem e massa do item. Com líquidos e sólidos, o volume varia muito, dependendo da densidade da substância. Isto acontece porque as partículas sólidas e líquidas são embaladas próximas umas das outras com muito pouco espaço entre as partículas. No entanto, os gases são em grande parte compostos por espaços vazios entre as partículas gasosas reais (ver figura abaixo).
Em 1811, Amadeo Avogadro explicou que os volumes de todos os gases podem ser facilmente determinados. A hipótese de Avogadro afirma que volumes iguais de todos os gases à mesma temperatura e pressão contêm números iguais de partículas. Como o volume total que um gás ocupa é composto principalmente pelo espaço vazio entre as partículas, o tamanho real das próprias partículas é quase insignificante. Um dado volume de um gás com pequenas partículas leves como o hidrogênio (esquerda (direita)) contém o mesmo número de partículas que o mesmo volume de um gás pesado com partículas grandes como o hexafluoreto de enxofre (hexafluoreto de enxofre) (direita).
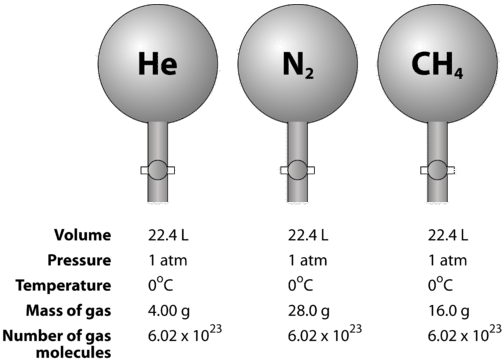
p>Gases são compressíveis, o que significa que quando colocados sob alta pressão, as partículas são forçadas a se aproximarem umas das outras. Isto diminui a quantidade de espaço vazio e reduz o volume do gás. O volume do gás também é afetado pela temperatura. Quando um gás é aquecido, suas moléculas se movem mais rapidamente e o gás se expande. Devido à variação no volume do gás devido às mudanças de pressão e temperatura, a comparação dos volumes de gás deve ser feita a uma temperatura e pressão padrão. A temperatura e pressão padrão (STP) é definida como pressão de texto (0 ^texto) e pressão de texto (1 ^texto). O volume molar de um gás é o volume de uma toupeira de um gás em STP. Em STP, uma toupeira (6,02 vezes 10^ (23) partículas representativas) de qualquer gás ocupa um volume de (22,4) (figura abaixo).

p> A figura abaixo ilustra como o volume molar pode ser visto ao comparar diferentes gases. Amostras de hélio, nitrogênio e metano estão em STP. Cada uma contém 1 toupeira ou partículas de 10^23. Contudo, a massa de cada gás é diferente e corresponde à massa molar desse gás: \(4.00: texto (g/mol) para o gás, (28.0: texto (g/mol) para o gás, e (16.0: texto (g/mol) para o gás, (16.0: texto (g/mol) para o gás.