19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- “R” group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
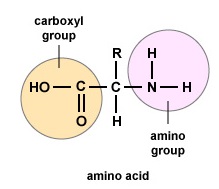
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Cada aminoácido difere em termos do seu grupo “R”. O grupo “R” de um aminoácido é o resto da molécula, ou seja, a porção diferente do grupo de aminoácidos, o grupo ácido, e o carbono central. Cada aminoácido diferente tem um grupo “R” único e as propriedades químicas únicas de um aminoácido dependem das do seu grupo “R” (Figura 1).
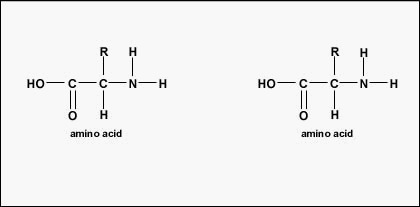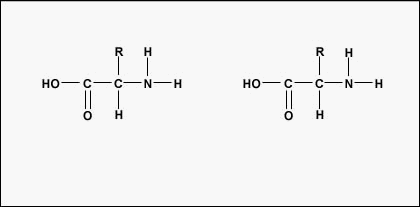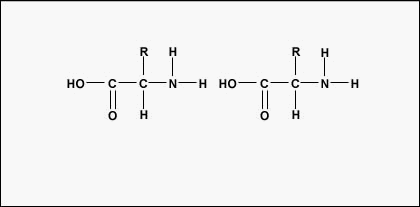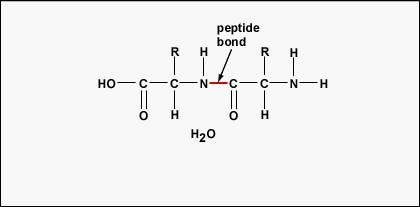
Para formar polipéptidos e proteínas, os aminoácidos são unidos por ligações de peptídeos, nos quais o amino ou NH2 de um aminoácido se liga ao grupo carboxil (ácido) ou COOH de outro aminoácido como mostrado na (Figura \PageIndex{2}} e Figura \PageIndex{3}).
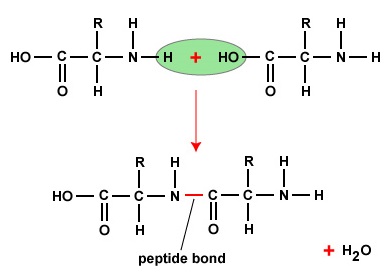
Um peptídeo é dois ou mais aminoácidos unidos por ligações peptídeas, e um polipéptido é uma cadeia de muitos aminoácidos. Uma proteína contém um ou mais polipeptídeos. Portanto, proteínas são cadeias longas de aminoácidos unidos por ligações de peptídeos.
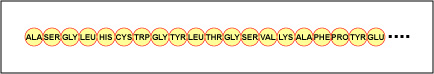
A ordem real dos aminoácidos na proteína é chamada de sua estrutura primária (Figura \PageIndex{4}}) e é determinada pelo DNA. Como será visto mais tarde nesta unidade, o DNA é dividido em unidades funcionais chamadas genes. Um gene é uma seqüência de bases de desoxirribonucleotídeos ao longo de uma cadeia de DNA que codifica para um produto funcional – uma molécula específica de RNA mensageiro, RNA de transferência, ou RNA ribossomal. O produto é geralmente RNA mensageiro (mRNA) e o mRNA acaba resultando na síntese de um polipéptido ou proteína. Portanto, é comumente dito que a ordem de bases de desoxirribonucleotídeos em um gene determina a seqüência de aminoácidos de uma determinada proteína. Como certos aminoácidos podem interagir com outros aminoácidos na mesma proteína, esta estrutura primária finalmente determina a forma final e, portanto, as propriedades químicas e físicas da proteína.
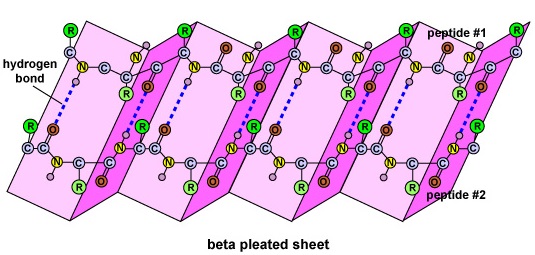
A estrutura secundária da proteína é devida às ligações de hidrogênio que se formam entre o átomo de oxigênio de um aminoácido e o átomo de nitrogênio de outro. Isto dá à proteína ou polipeptídeo a forma bidimensional de uma hélice alfa ou uma folha pregueada beta (Figura \PageIndex{5}}).
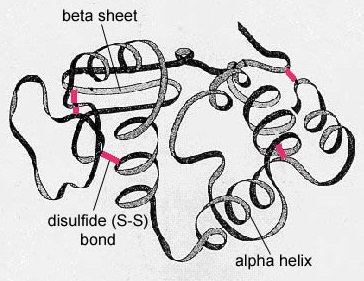
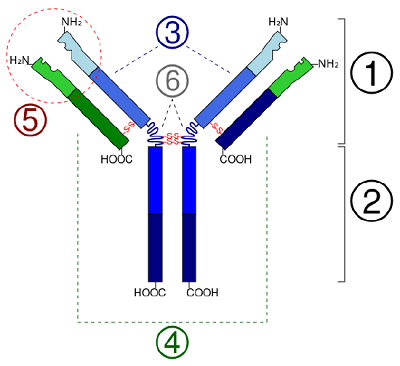
Em proteínas globulares como as enzimas, a longa cadeia de aminoácidos se dobra em uma forma tridimensional funcional ou estrutura terciária. Isto acontece porque certos aminoácidos com grupos sulfidrílicos ou SH formam ligações de dissulfureto (S-S) com outros aminoácidos na mesma cadeia. Outras interacções entre grupos R de aminoácidos como ligações de hidrogénio, ligações iónicas, ligações covalentes, e interacções hidrofóbicas também contribuem para a estrutura terciária (Figura \PageIndex{6}). Em algumas proteínas, tais como moléculas de anticorpos e hemoglobina, vários polipéptidos podem se ligar para formar uma estrutura quaternária (Figura \PageIndex{7}}).
Como será visto mais tarde nesta unidade, durante a síntese de proteína, a ordem de bases de nucleotídeos ao longo de um gene é transcrita em um fio complementar de mRNA que é então traduzido por tRNA na ordem correta de aminoácidos para aquele polipéptido ou proteína. Portanto, a ordem de bases de desoxirribonucleotídeos ao longo do DNA determina a ordem de aminoácidos nas proteínas. Porque certos aminoácidos podem interagir com outros aminoácidos, a ordem de aminoácidos para cada proteína determina a sua forma tridimensional final, que por sua vez determina a função daquela proteína (por exemplo, com que substrato uma enzima reagirá, com que epitopes o Fab de um anticorpo se combinará, a que receptores uma citocina se ligará).
Summary
- Aminoácidos são os blocos de construção das proteínas. Existem 20 aminoácidos diferentes comumente encontrados em proteínas e frequentemente 300 ou mais aminoácidos por molécula de proteína.
- Todos os aminoácidos contêm um amino ou grupo NH2 e um grupo carboxil (ácido) ou COOH.
- Para formar polipéptidos e proteínas, os aminoácidos são unidos por ligações de peptídeos, nos quais o amino ou NH2 de um aminoácido se liga ao carboxil (ácido) ou grupo COOH de outro aminoácido.
- Um peptídeo é dois ou mais aminoácidos unidos por ligações de peptídeos; um polipéptido é uma cadeia de muitos aminoácidos; e uma proteína contém um ou mais polipéptidos. Portanto, proteínas são longas cadeias de aminoácidos unidos por ligações de peptídeos.
- A ordem real dos aminoácidos na proteína é chamada sua estrutura primária e é determinada pelo DNA.
- A ordem das bases de desoxirribonucleotídeos em um gene determina a seqüência de aminoácidos de uma determinada proteína. Como certos aminoácidos podem interagir com outros aminoácidos na mesma proteína, esta estrutura primária determina, em última análise, a forma final e, portanto, as propriedades químicas e físicas da proteína.
- A estrutura secundária da proteína é devida às ligações de hidrogênio que se formam entre o átomo de oxigênio de um aminoácido e o átomo de nitrogênio de outro e dá à proteína ou polipeptídeo a forma bidimensional de uma hélice alfa ou de uma folha beta-pregueada.
- Em proteínas globulares como as enzimas, a longa cadeia de aminoácidos torna-se dobrada em uma forma tridimensional funcional ou estrutura terciária. Isto acontece porque certos aminoácidos com grupos sulfidrílicos ou SH formam ligações de dissulfureto (S-S) com outros aminoácidos na mesma cadeia. Outras interacções entre grupos R de aminoácidos, tais como ligações de hidrogénio, ligações iónicas, ligações covalentes e interacções hidrofóbicas também contribuem para a estrutura terciária.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)