2.3D: Teoria da Separação
Teoria Geral
TLC é uma excelente ferramenta analítica para separar misturas em uma amostra. Nesta seção são discutidos os detalhes da separação, e expandem a discussão geral da Seção 2.1.B.
Em todas as formas de cromatografia, as amostras se equilibram entre as fases estacionárias e móveis. Em quase todas as aplicações de TLC, a fase estacionária é um adsorvente de sílica ou alumina e a fase móvel é um solvente orgânico ou mistura de solventes (o “eluente”) que sobe a placa (equação 3).
\
Gel de sílica (mostrado na Figura 2.16) é composto de uma rede de ligações silício-oxigênio, com ligações {O-H}) na sua superfície, bem como uma camada de moléculas de água. O silicagel é utilizado nesta discussão, mas é estruturalmente análogo à alumina (esquerda(( esquerda( direita ))). Esta fase estacionária muito polar é pareada com uma fase móvel relativamente não polar (um solvente orgânico ou solução), no que é referido como TLC “fase normal”. Embora esta seja a forma mais comum de TLC (e no que será focado nesta seção), TLC “fase reversa” (com uma fase estacionária não polar e uma fase polar móvel) é às vezes usada.
Figure 2.16 mostra como a acetofenona se apegaria à superfície do gel de sílica através de forças intermoleculares (IMF’s). Neste caso, a acetofenona pode se ligar hidrogênio (o FMI indicado na Figura 2.16a) à superfície da sílica através de seu átomo de oxigênio. Como o eluente flui sobre a amostra (Figura 2.16b), um equilíbrio é estabelecido entre a amostra sendo adsorvida na fase estacionária e dissolvida na fase móvel. Quando na fase móvel, o composto move-se para cima da placa com o fluxo de líquido (Figura 2.16c) para mais tarde ler o eluente na fase estacionária mais acima da placa. O resultado \(R_f\) do composto depende do tempo gasto nas fases estacionária e móvel.
.png?revision=1&size=bestfit&width=1110&height=395)
A distribuição de equilíbrio entre as duas fases depende de vários fatores:
- Depende da força das forças intermoleculares entre a amostra e a fase estacionária.
Um composto que forma IMF’s fortes com a sílica ou alumina muitas vezes favorecerá a fase estacionária, e passará grande parte do tempo de eluição aderido à placa. Isto significa que ele passará menos tempo na fase móvel (que é o único meio de subir a placa), fazendo com que ela acabe ficando baixa na placa TLC, e tenha um valor baixo \(R_f\).
Compostos que possuem átomos de oxigênio ou nitrogênio devem ser capazes de se ligar a hidrogênio com a fase estacionária (ter IMF’s fortes com a fase estacionária), e assim terão valores mais baixos \(R_f\) do que compostos de tamanho similar que só podem interagir através das forças de dispersão de Londres (LDF’s). - Depende da força de interação entre a amostra e a fase móvel.
Como a fase móvel é sempre menos polar que a fase estacionária na fase TLC normal, os compostos polares tenderão a ter uma menor afinidade para a fase móvel do que os compostos não polares (baseado no princípio “como dissolve-se como”). Portanto, os compostos polares tendem a gastar menos tempo de eluição móvel do que um composto não-polar, portanto viajarão “mais devagar” pela placa, e terão uma baixa {\i1}(R_f\i}).
O grau de atração por um composto para as fases estacionárias e móveis leva à mesma conclusão:
- Quanto mais forte for o FMI possível com a fase estacionária (muitas vezes os grupos mais polares funcionais em um composto), mais tempo o composto será estacionário mais baixo.
- Quanto mais grupos polares funcionais presentes num composto, menos ele tende a ser atraído para o menos eluente polar, e menos tempo o composto será móvel inferior.17).
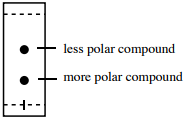
Figure 2.17: Relação de polaridade para \(R_f\).