4. Bases Fortes e Fracas
Bases Fracas
Amoníaco é uma típica base fraca. A amônia em si obviamente não contém íons hidróxidos, mas reage com água para produzir íons de amônia e íons hidróxidos.
\
No entanto, a reação é reversível, e a qualquer momento cerca de 99% da amônia ainda está presente como moléculas de amônia. Apenas cerca de 1% produziu realmente iões hidróxidos. Uma base fraca é aquela que não se converte totalmente em iões de hidróxido em solução. Quando uma base fraca reage com água, a posição de equilíbrio varia de base para base. Quanto mais à esquerda estiver, mais fraca é a base.
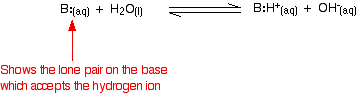
Você pode obter uma medida da posição de equilíbrio escrevendo uma constante de equilíbrio para a reação. Quanto menor o valor para a constante, mais o equilíbrio fica para a esquerda. Neste caso, a constante de equilíbrio é chamada de Kb. Isto é definido como:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other “p” terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |