Adipócitos
Adipócitos são os principais locais de armazenamento de energia no corpo, e também têm funções endócrinas críticas. Portanto, a compreensão do desenvolvimento e função dos adipócitos – particularmente à luz da pandemia de obesidade – é essencial para compreender a homeostase metabólica. Existem duas classes gerais de adipócitos; os adipócitos brancos – que armazenam energia como uma única gota grande de lipídios e têm importantes funções endócrinas, e os adipócitos castanhos – que armazenam energia em várias gotículas pequenas de lipídios, mas especificamente para uso como combustível para gerar calor corporal (ou seja, termogénese). A produção de calor pelos adipócitos marrons é possibilitada pela sua expressão única da proteína desacoplamento mitocondrial localizada 1 (Ucp1). No entanto, estas classificações são simplificadas porque alguns adipócitos brancos podem adoptar as características dos adipócitos castanhos (denominados adipócitos brite ou bege) e vice-versa, dependendo da temperatura e da dieta. Estamos interessados em compreender as origens dos diferentes adipócitos e em definir as vias de sinalização e metabólicas que controlam o seu desenvolvimento, distribuição e função.
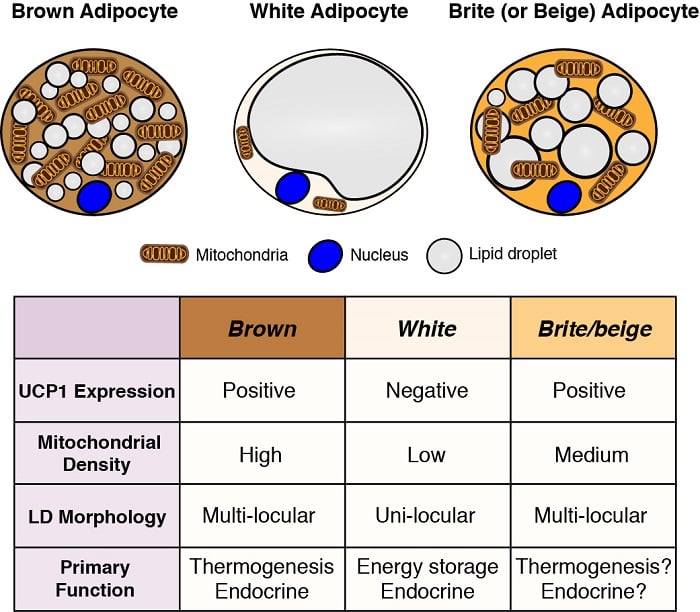
Das origens dos adipócitos
Central para entender o papel do tecido adiposo na saúde e na doença é entender como ele cresce e, nesse sentido, uma das áreas menos compreendidas da biologia do tecido adiposo é a origem do desenvolvimento dos diferentes tipos de adipócitos. A definição da origem dos adipócitos pode ajudar a explicar os padrões de distribuição da gordura corporal humana, particularmente em indivíduos obesos ou lipodistroficos, e pode fornecer pistas para as diferenças metabólicas observadas entre alguns depósitos de gordura. A identificação das células precursoras dos adipócitos e dos mecanismos que regulam a sua expansão também é fundamental para compreender e gerir a função saudável dos tecidos adiposos. Também pode ser possível engendrar o desenvolvimento de adipócitos “saudáveis” (como os adipócitos castanhos ou os adipócitos castanhos/beges) a partir de precursores para terapias baseadas em células destinadas essencialmente a combater a gordura com gordura. Utilizando uma combinação de genética e estratégias de rastreamento de linhagem, mapeamos previamente as origens dos adipócitos residentes em diferentes depósitos. Os nossos resultados revelam um nível inesperado de heterogeneidade consistente com adipócitos com múltiplas origens de desenvolvimento e que suportam um modelo em que o destino dos adipócitos provavelmente depende de factores extrínsecos e intrínsecos.
Adipócitos têm múltiplas origens de desenvolvimento
(abaixo à esquerda) Distribuição anatômica dos depósitos de tecido adiposo em um rato. São mostrados os depósitos de tecido adiposo castanho (BAT) e de tecido adiposo branco (WAT). (abaixo à direita) Um exemplo de um experimento de rastreamento de linhagem durante o qual células precursoras do desenvolvimento e todos os seus decendentes foram indelévelmente rotulados com uma marca fluorescente ligada à expressão de Myf5 (painel a) ou Pax3 (painel b). Os adipócitos marcados em verde (mGFP) são originários de uma célula precursora diferente e depois os adipócitos marcados em vermelho (mTFP).
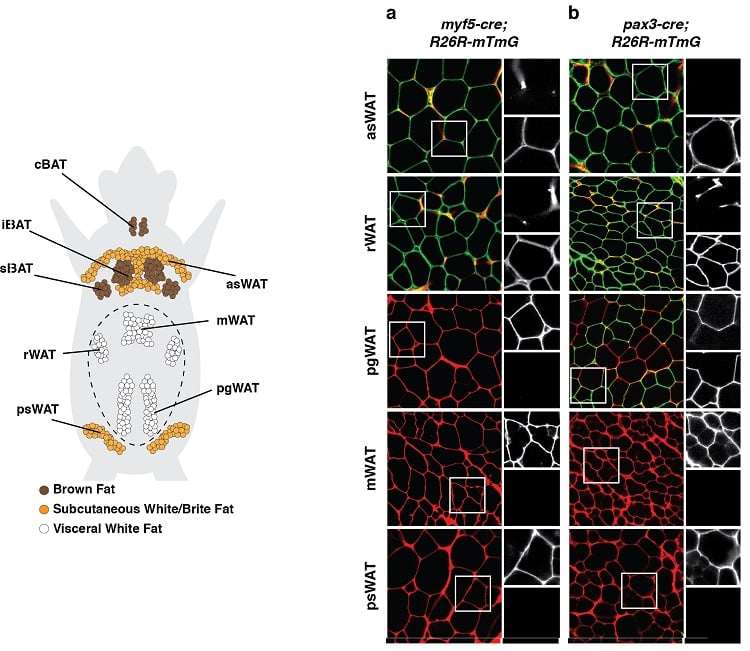
Resultados como estes sugerem que os adipócitos têm múltiplas origens de desenvolvimento.
(adaptado de Sanchez-Gurmaches & Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016)
Adipócitos castanhos
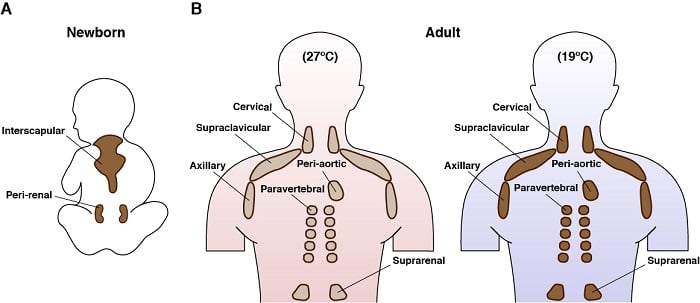
Adipócitos castanhos são células fascinantes. Eles só existem em mamíferos, e sua principal função é gerar calor endógeno em um processo chamado termogênese. Isto é possível pela sua expressão única de uma proteína da membrana mitocondrial chamada proteína de desacoplamento 1 (UCP1). As propriedades de gasto energético da gordura marrom, e a recente constatação de que os humanos adultos têm gordura marrom, fez deles um alvo para terapias destinadas a combater a supernutrição. Os adipócitos castanhos activos também têm um dos programas metabólicos mais intrigantes: absorvem e consomem grandes quantidades de diversos nutrientes em simultâneo (por exemplo, glucose, lípidos, aminoácidos) e podem simultaneamente envolver tanto o metabolismo anabólico como o catabólico. Por exemplo, nós e outros já mostramos anteriormente que a MTD estimulada pelo frio, em grande parte, upregula um programa genético que suporta as vias de síntese de novos lipídios, além das vias de oxidação de ácidos graxos. Gostaríamos de entender mais sobre este notável e paradoxal metabolismo.
Saiba mais sobre o desenvolvimento e metabolismo do tecido adiposo marrom
Localização anatômica da gordura marrom em humanos
Utilizamos também modelos genéticos para investigar como as vias de sinalização controlam o metabolismo da MTD. Por exemplo, utilizando ratos que eliminámos geneticamente Rictor – que codifica um componente único e essencial do mTORC2 – apenas em tecido adiposo castanho. Saiba mais sobre o mTORC2. Notavelmente, estes ratos estão protegidos de uma dieta rica em gordura. Mais especificamente, os ratos sem BAT Rictor não acumularam lípidos excessivos nos seus depósitos de tecido adiposo hepático ou visceral quando consumiram a dieta rica em gordura. Esta é uma descoberta emocionante, uma vez que o excesso de armazenamento de lípidos nestes locais é perigosamente insalubre. Usando uma combinação de genética, genómica, metabolómica e bioquímica, estamos a tentar compreender porque é que estes ratos estão protegidos de uma dieta rica em gordura.
Adipócitos brancos
Adipócitos brancos são os adipócitos mais abundantes em humanos. Os depósitos de tecido adiposo branco também têm uma notável capacidade de expansão e armazenamento de energia, e sinalizam para o cérebro e outros tecidos para influenciar fortemente o comportamento alimentar e a homeostase metabólica. No entanto, enquanto os adipócitos brancos estão especificamente adaptados para bloquear com segurança o excesso de nutrientes, eles têm um ponto de viragem (por exemplo, na obesidade) no qual as suas funções benéficas falham, e isto promove fortemente o aparecimento de doenças metabólicas e diabetes tipo 2. O que define o ponto de viragem? Como é que os adipócitos brancos sinalizam para outros tecidos? Quão heterogéneos são os depósitos de adipócitos brancos? Porque é que ter excesso de gordura visceral é mais prejudicial à sua saúde do que ter excesso de gordura subcutânea? Estas são todas as questões pendentes que nos interessam.
Estamos também a estudar a sinalização de mTOR nos adipócitos brancos. mTOR é um importante alvo a jusante da sinalização da insulina, que é a principal hormona a que os adipócitos respondem. Usando modelos genéticos de rato, inibimos selectivamente a mTORC1 ou mTORC2 em todos os adipócitos. A inibição do mTORC1 no tecido adiposo branco causa uma síndrome semelhante à lipodistrofia associada à resistência à insulina e à doença hepática adiposa. A inibição do mTORC2 no tecido adiposo branco também causa resistência à insulina, mas independentemente das alterações na massa do tecido adiposo. Neste último modelo, o mTORC2 parece regular um sinal derivado de adipócitos que se comunica com o fígado para controlar a produção de glicose hepática. O entendimento da base mecanicista destes fenótipos fornecerá informação crítica sobre como as vias de transdução de sinal de detecção de nutrientes contribuem para a patogênese das doenças relacionadas ao tecido adiposo.
Modelo de sinalização da mTORC2 em um adipócito branco
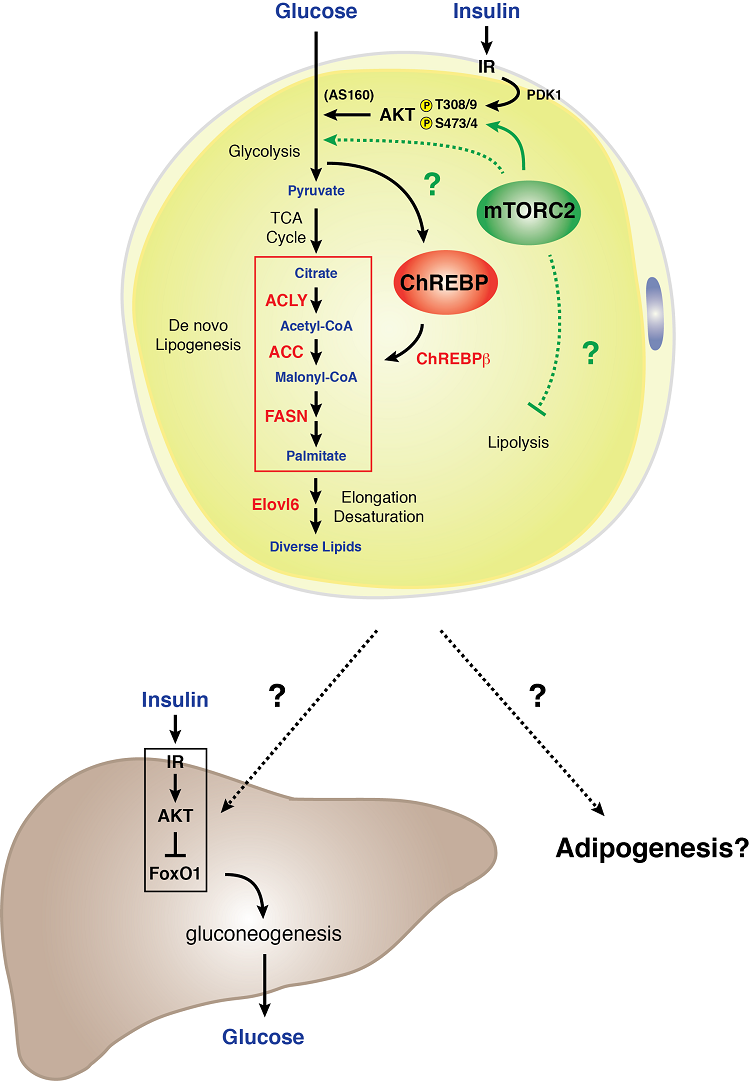 Adipócitos brancos requerem a mTORC2 para o metabolismo normal de carboidratos e lipídios. Verificamos que a perda genética de Rictor (mTORC2) especificamente nos adipócitos brancos reduz a absorção de glicose e atenua a expressão do fator de transcrição ChREBP-beta e seus alvos a jusante – o que inclui as enzimas que funcionam na via da lipogênese de novo. Além disso, uma deficiência de mTORC2 nas células gordas brancas resulta em resistência à insulina hepática severa. Estes dados indicam que o adipócito branco mTORC2 é um regulador essencial do metabolismo dos carboidratos e lipídios e é um componente chave de um mecanismo de comunicação órgão extra-hepático sensível aos nutrientes que controla a homeostase sistêmica da glicose. A compreensão da biologia da sinalização da mTORC2 na gordura branca pode conter pistas importantes de como o tecido adiposo branco funciona como um órgão sensor de glicose e mediador da aptidão metabólica sistêmica.
Adipócitos brancos requerem a mTORC2 para o metabolismo normal de carboidratos e lipídios. Verificamos que a perda genética de Rictor (mTORC2) especificamente nos adipócitos brancos reduz a absorção de glicose e atenua a expressão do fator de transcrição ChREBP-beta e seus alvos a jusante – o que inclui as enzimas que funcionam na via da lipogênese de novo. Além disso, uma deficiência de mTORC2 nas células gordas brancas resulta em resistência à insulina hepática severa. Estes dados indicam que o adipócito branco mTORC2 é um regulador essencial do metabolismo dos carboidratos e lipídios e é um componente chave de um mecanismo de comunicação órgão extra-hepático sensível aos nutrientes que controla a homeostase sistêmica da glicose. A compreensão da biologia da sinalização da mTORC2 na gordura branca pode conter pistas importantes de como o tecido adiposo branco funciona como um órgão sensor de glicose e mediador da aptidão metabólica sistêmica.