Early Ideas about Matter: From Democritus to Dalton
Teoria atómica moderna

Priestley, Lavoisier, e outros tinham lançado as bases do campo da química. Suas experiências mostraram que algumas substâncias podiam se combinar com outras para formar novos materiais, outras substâncias podiam ser quebradas para formar substâncias mais simples e alguns “elementos” chave não podiam ser quebrados mais. Mas o que poderia explicar este complexo conjunto de observações? John Dalton, um professor e cientista britânico excepcional, juntou as peças e desenvolveu a primeira teoria atómica moderna em 1803. Para saber mais sobre as experiências de Priestley e Lavoisier e como elas formaram a base das teorias de Dalton, tente a experiência interativa Playhouse de Dalton, ligada a abaixo.
Dalton tornou um hábito regular rastrear e registrar o tempo em sua cidade natal de Manchester, Inglaterra. Através de suas observações de neblina matinal e outros padrões meteorológicos, Dalton percebeu que a água podia existir como um gás que se misturava com o ar e ocupava o mesmo espaço que o ar. Os sólidos não podiam ocupar o mesmo espaço que um ao outro; por exemplo, o gelo não podia misturar-se com o ar. Então o que poderia permitir que a água às vezes se comportasse como um sólido e às vezes como um gás? Dalton percebeu que toda a matéria deve ser composta de pequenas partículas. No estado gasoso, essas partículas flutuavam livremente e podiam se misturar com outros gases, como Bernoulli havia proposto. Mas Dalton estendeu essa idéia para se aplicar a toda a matéria – gases, sólidos e líquidos. Dalton primeiro propôs parte de sua teoria atômica em 1803 e mais tarde refinou esses conceitos em seu clássico trabalho de 1808 Um Novo Sistema de Filosofia Química (que você pode acessar através de um link sob a aba Recursos).
teoria de Dalton tinha quatro conceitos principais:
-
Toda a matéria é composta de partículas indivisíveis chamadas átomos. Bernoulli, Dalton, e outros retrataram átomos como pequenas partículas semelhantes a bilhares em vários estados de movimento. Embora este conceito seja útil para nos ajudar a compreender os átomos, ele não é correto como veremos em módulos posteriores sobre a teoria atômica ligada ao fundo deste módulo.
-
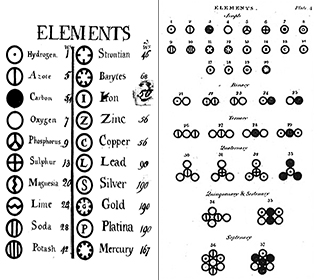
Todos os átomos de um dado elemento são idênticos; átomos de elementos diferentes têm propriedades diferentes. A teoria de Dalton sugeriu que cada átomo de um elemento como o oxigênio é idêntico a todos os outros átomos de oxigênio; além disso, átomos de elementos diferentes, como oxigênio e mercúrio, são diferentes uns dos outros. Dalton caracterizava os elementos de acordo com seu peso atômico; entretanto, quando isótopos de elementos foram descobertos no final do século XIX, este conceito mudou.
-
Reações químicas envolvem a combinação de átomos, não a destruição de átomos. Os átomos são indestrutíveis e imutáveis, por isso são formados compostos, como água e mercúrio calx, quando um átomo se combina quimicamente com outros átomos. Este era um conceito extremamente avançado para o seu tempo; enquanto a teoria de Dalton implicava que os átomos se uniam, seriam mais de 100 anos antes dos cientistas começarem a explicar o conceito de ligação química.
-
Quando os elementos reagem para formar compostos, eles reagem em proporções definidas de números inteiros. Os experimentos que Dalton e outros realizaram mostraram que as reações não são eventos aleatórios; elas procedem de acordo com fórmulas precisas e bem definidas. Este importante conceito em química é discutido com mais detalhes abaixo.
P>Ponto de verificação de compreensão
Um elemento é composto de
alguns dos detalhes da teoria atômica de Dalton requerem mais explicações.
Elementos: Já em 1660, Robert Boyle reconheceu que a definição grega de elemento (terra, fogo, ar e água) não era correta. Boyle propôs uma nova definição de um elemento como substância fundamental, e nós agora definimos elementos como substâncias fundamentais que não podem ser decompostas mais por meios químicos. Os elementos são os blocos de construção do universo. Eles são substâncias puras que formam a base de todos os materiais que nos rodeiam. Alguns elementos podem ser vistos em forma pura, como o mercúrio em um termômetro; alguns nós vemos principalmente em combinação química com outros, como o oxigênio e o hidrogênio na água. Conhecemos agora cerca de 116 elementos diferentes. A cada um dos elementos é dado um nome e uma abreviatura de uma ou duas letras. Muitas vezes esta abreviatura é simplesmente a primeira letra do elemento; por exemplo, hidrogênio é abreviado como H, e oxigênio como O. Algumas vezes um elemento recebe uma abreviatura de duas letras; por exemplo, hélio é Ele. Ao escrever a abreviatura de um elemento, a primeira letra é sempre maiúscula e a segunda letra (se houver) é sempre minúscula.
Atoms: Uma única unidade de um elemento é chamada de um átomo. O átomo é a unidade mais básica da matéria, que compõe tudo no mundo à nossa volta. Cada átomo retém todas as propriedades químicas e físicas de seu elemento pai. No final do século XIX, os cientistas mostrariam que os átomos eram na verdade compostos por peças menores, “subatómicas”, que esmagavam o conceito de bola de bilhar do átomo (ver a nossa Teoria Atómica I: O módulo dos Primeiros Dias).
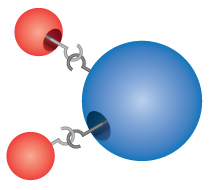
Compostos: A maioria dos materiais com os quais entramos em contacto são compostos, substâncias formadas pela combinação química de dois ou mais átomos dos elementos. Uma única “partícula” de um composto é chamada uma molécula. Dalton incorretamente imaginou que os átomos “engatinharam” juntos para formar moléculas. No entanto, Dalton percebeu corretamente que os compostos têm fórmulas precisas. A água, por exemplo, é sempre composta por duas partes de hidrogênio e uma parte de oxigênio. A fórmula química de um composto é escrita listando os símbolos dos elementos juntos, sem nenhum espaço entre eles. Se uma molécula contém mais de um átomo de um elemento, um número é subscrito após o símbolo para mostrar o número de átomos desse elemento na molécula. Assim a fórmula para água é H2O, nunca HO ou H2O2.
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.