Família do oxigênio
A família do oxigénio é composta pelos elementos que compõem o grupo 16 na tabela periódica: oxigénio, enxofre, selénio, telúrio e polónio. Todos estes elementos têm seis elétrons em seu nível de energia mais externo, contabilizando algumas propriedades químicas comuns entre eles. Em outro aspecto, os elementos são bastante diferentes uns dos outros. O oxigênio é um não-metal gasoso; o enxofre e o selênio são não-metálicos sólidos; o telúrio é um metalóide sólido; e o polônio é um metal sólido.
Palavras a Conhecer
Ácido: Substâncias que, quando dissolvidas em água, são capazes de reagir com uma base para formar sais e libertar iões de hidrogénio.
Allotrope: Uma de duas ou mais formas de um elemento.
Combustão: Uma forma de oxidação que ocorre tão rapidamente que se produz calor e luz perceptíveis.
Rachadura: O processo pelo qual moléculas grandes de hidrocarbonetos são decompostas em componentes menores.
Electrólise: O processo pelo qual uma corrente eléctrica causa uma alteração química, geralmente a decomposição de alguma substância.
Isótopos: Duas ou mais formas do mesmo elemento com o mesmo número de prótons mas diferentes números de neutrões no núcleo atómico.
Litosfera: A porção sólida da Terra, especialmente a região da crosta externa.
LOX: Uma abreviatura para oxigénio líquido.
Metalurgia: A ciência e tecnologia que trata de obter metais dos seus minérios e convertê-los em formas que tenham valor prático.
Oxigénio nascente: Uma alotróia de oxigénio cujas moléculas contêm um único átomo de oxigénio.
Ozono: Uma alotrópola de oxigénio que consiste em três átomos por molécula.
Gás produtor: Um combustível sintético que consiste principalmente de monóxido de carbono e gases de hidrogénio.
Proteínas: Moléculas grandes que são essenciais para a estrutura e funcionamento de todas as células vivas.
Decadência radioactiva: A forma previsível em que uma população de átomos de um elemento radioactivo se desintegra espontaneamente com o tempo.
Oxigénio
Oxigénio é um gás incolor, inodoro, sem sabor, com um ponto de fusão de -218°C (-360°F) e um ponto de ebulição de -183°C (-297°F). É o elemento mais abundante na crosta terrestre, constituindo cerca de um quarto da atmosfera em peso, cerca de metade da litosfera (crosta terrestre), e cerca de 85% da hidrosfera (os oceanos, lagos e outras formas de água). Ela ocorre tanto como um elemento livre como numa grande variedade de compostos. Na atmosfera, ele existe como oxigênio elementar, às vezes conhecido como dioxigênio, porque consiste de moléculas diatômicas, O 2 . Na água ocorre como óxido de hidrogênio, H 2 O, e na litosfera ocorre em compostos como óxidos, carbonatos, sulfatos, silicatos, fosfatos, e nitratos.
O oxigênio também existe em duas formas alotrópicas (formas física ou quimicamente diferentes da mesma substância): um átomo por molécula (O) e três átomos por molécula (O 3 ). A primeira alotrópica é conhecida como monatômico, ou oxigênio nascente, e a segunda como oxigênio triatômico, ou ozônio. Na maioria das circunstâncias na natureza, predomina a forma diatómica de oxigénio. Na parte superior da estratosfera, porém, a energia solar causa a decomposição da forma diatómica na forma monatómica, que pode então recombinar com moléculas diatómicas para formar ozono. A presença de ozono na atmosfera terrestre é crítica para a sobrevivência da vida na Terra, uma vez que essa alotrópola tem tendência para absorver radiação ultravioleta que de outra forma seria prejudicial ou mesmo fatal para a vida vegetal e animal na superfície do planeta.
O oxigênio foi descoberto independentemente pelo químico sueco Carl Scheele (1742-1786) e pelo químico inglês Joseph Priestley (1733-1804), no período entre 1773 e 1774. O elemento recebeu seu nome no final da década de 1770 pelo químico francês Antoine Laurent Lavoisier (1743-1794). Seu nome vem da palavra francesa para “acid-former”, que reflete a crença incorreta de Lavoisier de que todos os ácidos contêm oxigênio.
Produção. De longe o método mais comum para produzir oxigénio comercialmente é a destilação fraccionada do ar líquido. Uma amostra de ar é primeiramente resfriada a uma temperatura muito baixa na faixa de -200°C (-330°F). A esta temperatura, a maioria dos gases que compõem o ar tornam-se líquidos. O ar líquido pode então evaporar. A uma temperatura de cerca de -196°C (-320°F), o nitrogênio começa a ferver. Quando a maior parte do nitrogênio desaparece, o argônio e o néon também fervem, deixando uma forma impura de oxigênio para trás. O oxigênio é impuro porque pequenas quantidades de krypton, xenon e outros gases podem permanecer na forma líquida. A fim de purificar ainda mais o oxigênio, o processo de resfriamento, liquefação e evaporação pode ser repetido.
O oxigênio é normalmente armazenado e transportado em sua forma líquida, uma forma também conhecida como LOX (para l iquid ox ygen). Os recipientes LOX parecem ser garrafas de vácuo muito grandes que consistem num recipiente de parede dupla com um vácuo entre as paredes. O elemento também pode ser armazenado e transportado menos facilmente na forma gasosa em recipientes com paredes de aço com cerca de 1,2 metros de altura e 23 centímetros de diâmetro. Em muitos casos, o oxigênio é fabricado no local onde será utilizado. O processo de destilação fraccionada descrito anteriormente é suficientemente simples e barato para que muitas indústrias possam fornecer as suas próprias instalações de produção de oxigénio.
Utilizações. O oxigênio tem tantos usos comerciais, industriais e outros que está consistentemente entre os cinco principais produtos químicos em volume de produção nos Estados Unidos. Em 1990, por exemplo, cerca de 18 bilhões de quilos (39 bilhões de libras) do elemento foram fabricados nos Estados Unidos.
Os usos aos quais o oxigênio é colocado podem ser classificados em quatro grandes categorias: metalurgia, roquetes, síntese química e medicina. No processamento de minério de ferro em um alto-forno, por exemplo, o oxigênio é usado para converter coque (carbono) em monóxido de carbono. O monóxido de carbono, por sua vez, reduz os óxidos de ferro ao metal de ferro puro. O oxigênio é então utilizado em uma segunda etapa do processamento do ferro no conversor de Bessemer, em fornos abertos, ou no método básico de processamento de oxigênio para converter “ferro-gusa” em aço. Nesta etapa, o oxigênio é usado para reagir com o excesso de carbono, silício e metais restantes no ferro-gusa que devem ser removidos para produzir aço.
Outra aplicação metalúrgica de oxigênio é em tochas utilizadas para soldagem e corte. As duas tochas mais comuns fazem uso da reação entre oxigênio e hidrogênio (a tocha oxidrogenada) ou entre oxigênio e acetileno (a tocha oxiacetilênica). Ambos os tipos de tochas produzem temperaturas na faixa de 3.000°C (5.400°F) ou mais e podem, portanto, ser usadas para cortar ou soldar a grande maioria dos materiais metálicos.
Na forma de LOX, o oxigênio é amplamente utilizado como agente oxidante em muitos tipos de foguetes e mísseis. Por exemplo, o enorme tanque de combustível externo necessário para elevar o ônibus espacial para o espaço contém 550.000 litros (145.000 galões) de oxigênio líquido e 1.500.000 litros (390.000 galões) de hidrogênio líquido. Quando estes dois elementos reagem nos motores principais do vaivém, eles fornecem um impulso máximo de 512.000 libras.
A indústria química utiliza grandes quantidades de oxigênio todos os anos em uma variedade de reações de síntese (formação) química. Uma das mais importantes delas é o craqueamento de hidrocarbonetos pelo oxigênio. Na maioria das circunstâncias, aquecer um hidrocarboneto com oxigênio resulta em combustão, tendo o dióxido de carbono e a água como principais produtos. No entanto, se a taxa de alimentação de oxigênio em uma mistura de hidrocarbonetos for cuidadosamente controlada, o hidrocarboneto é “rachado” ou quebrado para produzir outros produtos, tais como acetileno, etileno e propileno.
Vários tipos de combustíveis sintéticos também podem ser fabricados com oxigênio como um dos principais reagentes. O gás produtor, como exemplo, é fabricado passando oxigênio a uma taxa controlada através de um leito de carvão quente ou coque. A maioria do dióxido de carbono produzido nesta reação é reduzida a monóxido de carbono, de modo que o produto final (o gás produtor) consiste principalmente de monóxido de carbono e hidrogênio.
Talvez a aplicação médica mais conhecida de oxigénio seja na oxigenoterapia, onde os pacientes que estão com dificuldades respiratórias recebem doses de oxigénio puro ou quase puro. A oxigenoterapia é frequentemente utilizada durante procedimentos cirúrgicos, durante o parto, durante a recuperação de ataques cardíacos, e durante o tratamento de doenças infecciosas. Em cada caso, fornecer oxigênio puro a uma pessoa reduz o estresse no coração e nos pulmões, acelerando a taxa de recuperação.
Oxigénio puro ou ar enriquecido com oxigénio também pode ser fornecido em ambientes onde a respiração pode ser difícil. As aeronaves que voam a grandes altitudes, claro, são sempre abastecidas com oxigénio em caso de qualquer problema com o fornecimento normal de ar da nave. Os mergulhadores de alto mar também levam consigo ou bombearam para eles suprimentos de ar que são enriquecidos com oxigênio.
Algumas estações de purificação de água e tratamento de esgotos utilizam oxigénio. O gás é bombeado através da água para aumentar a taxa na qual as bactérias que ocorrem naturalmente decompõem os resíduos orgânicos. Um processo semelhante foi encontrado para reduzir a taxa de eutrofização em lagos e lagos e, em alguns casos, para realmente reverter esse processo. (A eutrofização é a dissolução de nutrientes num corpo de água. O crescimento da vida das plantas aquáticas e a diminuição do oxigénio dissolvido são os dois principais resultados do processo).
Finalmente, o oxigénio é essencial para toda a vida animal na Terra. Uma pessoa pode sobreviver alguns dias ou semanas sem água ou comida, mas não mais do que alguns minutos sem oxigénio. Na ausência de oxigênio, as reações químicas geradoras de energia que ocorrem dentro das células chegariam ao fim, e uma pessoa morreria.
Enxofre
Enxofre é um elemento não metálico que pode existir em muitas formas alotrópicas (física ou quimicamente diferentes formas da mesma substância). Os mais familiares são chamados de enxofre rômbico e monoclínico. Ambos são sólidos amarelos brilhantes com pontos de fusão de cerca de 115°C (239°F). Uma terceira forma é chamada de enxofre plástico ou amorfo. É um líquido pardo produzido quando o enxofre rômbico ou monoclínico é derretido.
O enxofre em si não tem odor nenhum. Tem uma má reputação a este respeito, no entanto, porque alguns dos seus compostos mais comuns têm cheiros fortes. O dióxido de enxofre, um destes compostos, tem um efeito afiado, sufocante e asfixiante em qualquer pessoa que o respire. O “fogo e enxofre” da Bíblia foi um dos piores castigos que seus autores poderiam imaginar. O enxofre nesta expressão referia-se à queima de enxofre, ou dióxido de enxofre. O fato de que o enxofre vem do fundo do solo e que o dióxido de enxofre pode ser cheirado nos vapores dos vulcões alimentou ainda mais a imaginação das pessoas sobre como deve ser o inferno.
Um segundo composto de enxofre com um mau cheiro é o sulfureto de hidrogénio. O cheiro forte de ovos podres é devido à presença deste composto.
Ocorrência e preparação. O enxofre é o décimo sexto elemento mais abundante na crosta terrestre. Ocorre tanto como um elemento como em uma variedade de compostos. Como elemento pode ser encontrado em minas muito grandes, subterrâneas, mais comumente ao longo da costa do Golfo dos Estados Unidos e na Polônia e Sicília. O enxofre é extraído destas minas por meio do processo Frasch. Neste processo, o vapor superaquecido é bombeado através da extremidade de um conjunto de três tubos. O ar comprimido é forçado a descer pela tubulação mais interna. O vapor superaquecido provoca o derretimento do enxofre subterrâneo, e o ar comprimido força-o para cima, através do meio dos três tubos, até a superfície da Terra.
O enxofre também é amplamente distribuído sob a forma de minerais e minérios. Muitos destes estão na forma de sulfatos, incluindo gipsita (sulfato de cálcio, CaSO 4 ), barita (sulfato de bário, BaSO 4 ), e sais de Epsom (sulfato de magnésio, MgSO 4 ). Outros são sulfetos metálicos, incluindo pirites de ferro (sulfeto de ferro, FeS 2 ), galena (sulfeto de chumbo, PbS), cinabar (sulfeto mercúrico, HgS), stibnite (sulfeto antimônio, Sb 2 S 3 ), e zinco blende (sulfeto de zinco, ZnS). O enxofre é recuperado destes minérios metálicos aquecendo-os fortemente no ar, o que converte o enxofre em dióxido de enxofre e liberta o metal puro. Então o dióxido de enxofre pode ir diretamente para a fabricação de ácido sulfúrico, que é onde mais de 90 por cento do enxofre minado do mundo acaba.
Usos do enxofre e seus compostos. Algum enxofre é usado diretamente como fungicida e inseticida, em fósforos, fogos de artifício e pólvora, e na vulcanização da borracha natural (um tratamento que dá elasticidade e força à borracha). A maioria, porém, é convertida em uma multidão de compostos úteis.
O ácido sulfúrico é de longe o mais importante de todos os compostos de enxofre. Quase 90% de todo o enxofre produzido é convertido primeiro em dióxido de enxofre e depois em ácido sulfúrico. O ácido é consistentemente o número um entre os produtos químicos produzidos nos Estados Unidos. Em 1990, foram fabricados mais de 40 bilhões de quilos de ácido sulfúrico, mais de 50 por cento do que o segundo produto químico mais popular (gás nitrogênio). O ácido sulfúrico é usado na produção de fertilizantes, baterias de automóveis, produtos petrolíferos, pigmentos, ferro e aço, e muitos outros produtos.
O ciclo do enxofre. Como nitrogênio, carbono e fósforo, o enxofre passa através das partes gasosas, líquidas e sólidas do nosso planeta em uma série de reações contínuas conhecidas como o ciclo do enxofre. As principais etapas do ciclo do enxofre são ilustradas na figura em anexo.
O enxofre é produzido naturalmente como resultado de erupções vulcânicas e através de emissões de fontes termais. Ele entra na atmosfera principalmente na forma de dióxido de enxofre, depois permanece na atmosfera nessa forma ou, após reagir com água, sob a forma de ácido sulfúrico. O enxofre é levado de volta à superfície da Terra como deposição ácida quando chove ou neva.
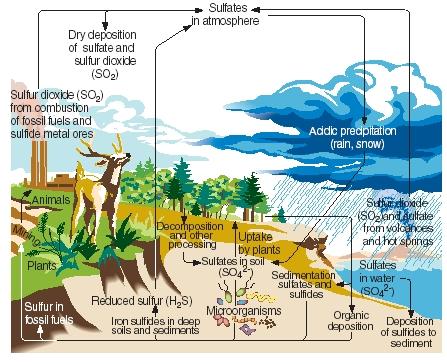
.)
Na superfície da Terra, dióxido de enxofre e ácido sulfúrico reagem com metais para formar sulfatos e sulfuretos. O elemento também é incorporado pelas plantas numa forma conhecida como enxofre orgânico. Certos aminoácidos, os compostos a partir dos quais são feitas as proteínas, contêm enxofre. O enxofre orgânico das plantas é eventualmente transmitido aos animais que se alimentam dessas plantas. Ele é, por sua vez, convertido de proteínas vegetais em proteínas animais.
Quando plantas e animais morrem, o enxofre é devolvido ao solo onde é convertido por microrganismos em sulfureto de hidrogénio. O gás sulfureto de hidrogénio é então devolvido à atmosfera, onde é oxidado em ácido sulfúrico.
As atividades humanas influenciam o ciclo do enxofre de várias maneiras. Por exemplo, quando carvão e minérios metálicos são extraídos, enxofre e sulfuretos podem ser liberados e devolvidos ao solo. Além disso, a combustão de carvão, petróleo e gás natural freqüentemente libera dióxido de enxofre para a atmosfera. Este dióxido de enxofre é adicionado à quantidade já presente de fontes naturais, aumentando grandemente a quantidade de precipitação ácida que cai à superfície da Terra. Algumas pessoas acreditam que a precipitação ácida (ou chuva ácida) é responsável pela morte de árvores e outras plantas, a acidificação de lagos que tem ferido animais marinhos, danos a estruturas de metal e pedra, e outros danos ambientais.
Selénio, telúrio e polónio
Selénio e telúrio são ambos elementos relativamente raros. Eles estão entre os dez por cento mais baixos de todos os elementos em termos de abundância. Eles tendem a ocorrer na crosta terrestre em associação com minérios de cobre e outros metais. Ambos são obtidos como um subproduto do refino eletrolítico do cobre. Durante esse processo, eles afundam no fundo do tanque de eletrólise, onde podem ser removidos da lama que se desenvolve.
Selénio ocorre em diversas formas alotrópicas (física ou quimicamente diferentes da mesma substância), sendo a mais comum o pó vermelho que se torna preto quando exposto ao ar. O ponto de fusão do elemento é 217°C (423°F), e seu ponto de ebulição é 685°C (1.265°F). O telúrio é um sólido branco prateado que se parece com um metal (embora na verdade seja um metalóide). Seu ponto de fusão é de 450°C (842°F), e seu ponto de ebulição é de 990°C (1.814°F).
O selénio tem um papel interessante nos organismos vivos. É essencial em concentrações muito baixas para manter a saúde na maioria dos animais. De facto, é muitas vezes adicionado à alimentação animal. Em concentrações mais elevadas, no entanto, o elemento tem tido efeitos nocivos nos animais, causando jovens deformados e adultos doentes.
Os principais usos do selénio são na electrónica e na fabricação de vidro colorido. Máquinas fotocopiadoras, células solares, fotocélulas, tubos de imagem de televisão e retificadores e relés eletrônicos (usados para controlar o fluxo de corrente elétrica), todos usam selênio. Alguns dos vidros coloridos mais bonitos, desde o rosa pálido aos vermelhos brilhantes, são feitos com compostos de selênio.
Pequenas quantidades de telúrio também são utilizadas na produção de vidros coloridos. Mais de 90% do elemento, porém, vai para a produção de ligas de ferro e outros metais.
O polónio tem 27 isótopos, todos eles radioactivos. Ocorre naturalmente nos minérios de urânio, onde é o produto final na longa série de reações pelas quais o urânio sofre decaimento radioativo. É um dos elementos mais raros da Terra, com uma abundância não superior a cerca de 3 × 10 -10 partes por milhão. A descoberta do polónio em 1898 pela Química polaco-francesa Marie Curie (1867-1934) é uma das histórias mais dramáticas da história da ciência. Ela processou toneladas de minério de urânio a fim de obter alguns miligramas do novo elemento, que ela então batizou com o nome de sua terra natal, a Polônia. O polônio encontra uso limitado em dispositivos geradores de energia altamente especializados, como os utilizados para satélites espaciais e sondas espaciais.