Frontiers in Neurology
Introdução
Paralisia horizontal bilateral do olhar é uma apresentação rara causada pela interrupção bilateral do fasciculus longitudinal mediano, núcleo abdutor ou formação reticular paramediana pontina (PPRF) (1, 2). Os tipos de movimentos oculares que podem ser afetados nas lesões do tronco cerebral incluem movimentos oculares lentos horizontais e verticais, movimentos de perseguição, respostas vestibulares e optocinéticas, e movimentos oculares rápidos, incluindo sacadas voluntárias ou evocadas e fases rápidas de estímulos vestibulares e optocinéticos. O controle de vergência pode ser afetado por lesões do cérebro médio.
Paralisia do olhar orizontal tem sido descrito como conseqüência de infarto (3), inflamação/demielinização como parte da esclerose múltipla (EM) ou distúrbios do espectro da neuromielite óptica (NMOSD) (2, 4, 5), hemorragia (6), e metástase (7). Dos casos anteriormente relatados, cinco dos seis tinham paralisia bilateral horizontal do olhar e três tinham lesões solitárias por ressonância magnética (RM), localizadas ao tegmento pontino. Milea et al. (1) relataram dois casos de oftalmoplegia internuclear bilateral (INO) transformando-se em paralisia horizontal bilateral com lesões únicas em T2, no mesmo local com a mesma morfologia da nossa série de casos. Sugeriram a EM como provável diagnóstico.
Henderson descreveu um paciente com diplopia horizontal no olhar lateral esquerdo e fraqueza na adução (8). A RM demonstrou uma lesão solitária do tronco cerebral em T2 hiperintenso adjacente ao quarto ventrículo, e foi feito o diagnóstico de EM. Na ausência de informações clínicas adicionais, é difícil discernir como este diagnóstico foi feito. Matsui et al. relataram um paciente com queixa de diplopia horizontal com paresia horizontal bilateral do olhar (9). Foi feito o diagnóstico de encefalite cerebral de Bickerstaff (BBE), embora as características clínicas fossem inconsistentes com os critérios diagnósticos (10).
Aqui, descrevemos três pacientes com paresia horizontal bilateral do olhar, causada em cada caso por uma lesão solitária e inflamatória que afeta o tegmento dorsal das pons, estendendo-se para a região do fasciculus longitudinal médio (MLF). Acreditamos que estes três casos evidenciam questões relativas à patogênese de tais síndromes e à relação de projeção horizontal e vertical do olhar para o MLF em particular.
Em conformidade com os requisitos éticos da nossa instituição, Royal Melbourne Hospital, foi obtido consentimento escrito e informado para o uso de dados anonimizados de todos os pacientes.
Patiente 1
Um homem de 38 anos de idade, de origem turca, apresentou diplopia aguda intermitente, tonturas e vômitos; foi diagnosticado com vertigem periférica e teve alta. Uma semana mais tarde, ele reapresentou com entorpecimento facial do lado esquerdo. Sua história médica pessoal, revisão do sistema e histórico familiar eram incomparáveis.
Acuidade visual era de 0,63 OU, medida na escala decimal. O diâmetro da pupila era de 5 mm bilateralmente e não-reativo. O exame da motilidade ocular (Tabela 1) revelou falha completa de todos os movimentos horizontais dos olhos, sacadas voluntárias, perseguição suave, movimentos vestibulares e optocinéticos. As sacadas verticais, a perseguição suave e os movimentos vestibulares estavam intactos ao exame clínico, mas isso não exclui a possibilidade de uma pequena desaceleração que teria exigido uma oculografia para identificação. O exame neurológico foi normal.
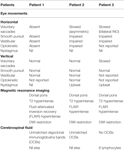 p>Tabela 1. Resumo dos achados clínicos oculomotores, achados de RM e resultados do líquor.
p>Tabela 1. Resumo dos achados clínicos oculomotores, achados de RM e resultados do líquor. RM mostrou uma lesão triangular hiperintensa em T2 e recuperação de inversão atenuada por fluido (FLAIR) dentro das pônulas dorsais no assoalho do quarto ventrículo (Figura 1A). A lesão mostrou difusão discretamente restrita, compatível com o mapeamento do coeficiente de difusão aparente, consistente com relatos na literatura como ocorrendo com lesões inflamatórias/demielinizantes (11, 12), e não exibiu realce de contraste. A ressonância magnética do cérebro e coluna vertebral era, de outra forma, pouco marcante. A lesão de tronco encefálico foi considerada como tendo características consistentes com a desmielinização, embora não tenham sido observadas outras lesões. A doença de Behçet, vasculite ou lesão mitótica foram consideradas diagnósticos diferenciais.
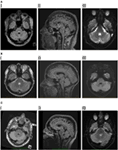 p>Figura 1. (A) I. Paciente 1, recuperação da inversão axial atenuada por fluido (FLAIR) mostrando lesão hiperintensa no tegmento pontino posterior. II. FLAIR sagital mostrando a extensão vertical da lesão. III. Imagem ponderada pela difusão, mostrando leve restrição de difusão. (B) I. Paciente 2, duplo axial mostrando lesão hiperintensa no tegmento do pontino posterior. II. LUZ SAGGITAL mostrando extensão vertical da lesão. III. Imagem ponderada pela difusão, mostrando restrição leve à difusão. (C) I. Paciente 3, flair axial mostrando lesão hiperintensa no tegmento do pontino posterior, ligeiramente mais significativa no lado direito. II. FlAIR sagital mostrando extensão vertical da lesão, ligeiramente maior do que os dois pacientes anteriores, consistente com alguma desaceleração das sacadas verticais. III. Imagens ponderadas por difusão mostrando leve restrição de difusão.
p>Figura 1. (A) I. Paciente 1, recuperação da inversão axial atenuada por fluido (FLAIR) mostrando lesão hiperintensa no tegmento pontino posterior. II. FLAIR sagital mostrando a extensão vertical da lesão. III. Imagem ponderada pela difusão, mostrando leve restrição de difusão. (B) I. Paciente 2, duplo axial mostrando lesão hiperintensa no tegmento do pontino posterior. II. LUZ SAGGITAL mostrando extensão vertical da lesão. III. Imagem ponderada pela difusão, mostrando restrição leve à difusão. (C) I. Paciente 3, flair axial mostrando lesão hiperintensa no tegmento do pontino posterior, ligeiramente mais significativa no lado direito. II. FlAIR sagital mostrando extensão vertical da lesão, ligeiramente maior do que os dois pacientes anteriores, consistente com alguma desaceleração das sacadas verticais. III. Imagens ponderadas por difusão mostrando leve restrição de difusão. Análise do líquido cerebroespinhal (LCR) revelou três linfócitos, nenhum polimorfismo, e nenhum glóbulo vermelho, bandas de imunoglobulinas oligoclonais (OCBs) foram vistas no LCR e foram inigualáveis no soro. Havia uma proteína minimamente elevada (0,46 g/l), mas o teste foi negativo para anti-aquaporina 4 (Aq4). O soro Aq4 também foi negativo. Os testes para anticorpos anti-gangliosídeos não foram feitos e os anticorpos anti-mielina oligodendrócitos glicoproteína (MOG) não estavam disponíveis na altura da doença aguda, mas foram negativos quando ficaram disponíveis 2 anos mais tarde.
O doente foi tratado para uma suposta desmielinização e melhorou após 3 dias de 1 g de metilprednisolona intravenosa (IV). Seu exame neurológico havia retornado ao normal após 3 semanas após a alta. A RMS seriada do cérebro demonstrou resolução completa da lesão pontina, sem novas lesões observadas e sem novos episódios clínicos durante 2 anos desde a apresentação inicial.
Patiente 2
Uma mulher de 46 anos de idade que apresentava dor de cabeça frontal foi tratada para enxaqueca e inicialmente respondeu a naproxen e amitriptilina. Seis dias depois, ela reapresentou com agravamento da dor de cabeça, fotofobia, visão turva, diplopia horizontal intermitente e dormência facial flutuante.
A sua história médica e familiar não eram notáveis. O exame neuro-oftámico revelou acuidade visual de 0,32 OU. As respostas pupilares foram relatadas como ligeiramente lentas mas reactivas bilateralmente. O exame oculomotor está resumido na Tabela 1. Houve uma paresia bilateral assimétrica dos olhares horizontais, pior à direita do que à esquerda. As sacadas para a direita foram restritas em amplitude e lentas. As respostas vestibulares foram assimétricas, com manobras da cabeça do boneco evocando movimentos oculares normais no olho esquerdo, mas restritas no direito. Respostas mais ativas do impulso da cabeça eram hipoativas bilateralmente. O nistagmo otimista era mais evidente no upgaze, mas com a oftalmoscopia também era notado na posição primária. As sacadas verticais, para cima e para baixo, eram normais. A perseguição vertical suave parecia intacta. Os impulsos verticais da cabeça e as respostas optocinéticas eram clinicamente normais. A video oculografia não estava disponível e, em geral, estes achados foram interpretados como sendo consistentes com um leve comprometimento do olhar vertical. O nistagmo vertical foi resolvido em 2 dias. Ela também apresentava leve fraqueza facial bilateral, ausência de reflexos tendinosos nos membros superiores e leve ataxia da marcha. A impressão clínica foi de que sua constelação de sintomas era consistente com a Síndrome de Miller Fisher, BBE ou desmielinização central, mas sem evidências para confirmar o diagnóstico dessas entidades nos testes.
Ressonância magnética cerebral revelou um foco paramediano solitário e bem definido de hiperintensidade T2 nos pons dorsais, que apresentava difusão levemente restrita, mas sem realce de contraste (Figura 1B). A coluna vertebral da RM estava normal.
Estudos de condução nervosa revelaram neuropatia axonal motora facial bilateral. A análise do líquor demonstrou OCBs (inigualável) e albumina elevada (298 mg/l). O anticorpo sérico Aq4 foi negativo. Os resultados do LCR de rotina foram normais, incluindo proteína 0,4 g/l, contagem de leucócitos (CIC) e contagem de eritrócitos (CCR) < 1. O LCR foi negativo para anticorpos anti-AQP4, anti-GM1, anti-GQ1B e anti-mielina-oligodendrócitos.
O diagnóstico foi de uma encefalite localizada restrita aos pons e afetando principalmente o tegmento dorsal. O paciente foi tratado com um curso de 5 dias de imunoglobulina IV de 2 g/kg. Durante a semana seguinte, a oftalmoplegia melhorou significativamente, os reflexos dos membros superiores melhoraram e a ataxia foi resolvida. Não foram identificados novos sintomas ou lesões ao longo de 12 meses de seguimento. Revisão aos 18 meses confirmou recuperação clínica completa.
Paciente 3
Este homem de 29 anos acordou com suores e calafrios, seguido por dor de cabeça bifrontal, vertigem postural, náuseas e vômitos. Na apresentação 12 h depois, ele teve diplopia horizontal e dormência do lado direito. Ele revelou uma história de 5 dias de sintomas do trato respiratório superior, seios nasais bloqueados e um reforço da imunização de coqueluche 1 mês antes do início dos sintomas. Sua história incluía hipertensão, hipotireoidismo, ansiedade, síndrome do intestino irritável, obesidade e esteato-hepatite não alcoólica.
Ressonância magnética cerebral revelou uma lesão de pontina dorsal hiperintensa em T2, não-aumentadora do lado esquerdo, que demonstrou difusão restrita (Figura 1C). O líquor foi notável por um CIC elevado de 8 × 106/l (7 linfócitos, 1 neutrofílica), o CCR foi de 4 × 106/l e a proteína do LCR foi de 0,35 g/l. Isto foi inicialmente diagnosticado como AVC isquêmico, em outra instituição, e a terapia médica para prevenção secundária foi iniciada. Não foram encontradas anormalidades na angiografia por ressonância magnética, monitorização cardíaca, ecocardiograma transesofágico, vasculite e telas de trombofilia.
Duas semanas após o início ele desenvolveu alteração do gosto do lado esquerdo, língua esquerda, boca interna e dormência facial. Sua acuidade visual monocular foi de 1,0 OU, mas a acuidade visual dinâmica foi de 0,4 OU. As respostas das pupilas eram normais. Ele demonstrou paresia bilateral do olhar e INO (Tabela 1). As respostas da cabeça foram bilateralmente hipoativas com sacadas levemente lentas para cima e nistagmo otimista no upgaze. O restante do exame neurológico revelou apenas leve dismetria esquerda.
Análise do LCR de repetição revelou 3 leucócitos (indiferenciados), 27 eritrócitos e negativo para OCBs. A RM não-contraste Cérebro revelou aumento da lesão com difusão persistente restrita. As aparências foram relatadas consistentes com a desmielinização. Anticorpos anti-gangliosídeos séricos, anticorpos anti-aquaporina-4 (AQP4), e anticorpos anti-MOG foram negativos.
Foi tratado com um curso de 3 dias de 1 g de metilprednisolona IV diária, seguido por 60 mg de prednisolona oral diariamente, desmamado lentamente após 1 mês. Um exame de seguimento 8 semanas após a primeira apresentação demonstrou um resíduo de INO esquerda e sintomas sensoriais à direita apenas, e estes foram resolvidos nos meses seguintes. A lesão resolvida completamente no seguimento 3 meses depois.
Discussão
Descrevemos três casos de paresia bilateral horizontal do olhar, coincidindo com o desenvolvimento agudo de uma lesão pequena e bem circunscrita do tegmento pontine na RM. Por definição, estes casos representam síndromes clinicamente isoladas, mas na ausência de lesões recorrentes em 12-36 meses de seguimento. O fenótipo é descrito em EM, NMOSD, acidente vascular cerebral e tumor (1, 4, 5, 8, 9, 13, 14). Entretanto, pacientes com estes diagnósticos tendem a desenvolver recidivas e alterações características da RM (4, 15). Em nossos casos, não há evidências suficientes para qualquer um destes diagnósticos na apresentação ou no acompanhamento. Enfocamos aqui as novidades clínicas e anatômicas propostas que elas demonstram.
As desordens do espectro Anti-GQ1b podem afetar os movimentos oculares e podem potencialmente se apresentar com as características clínicas que descrevemos. A síndrome de sobreposição Miller-Fisher/BBE foi considerada no segundo caso, mas esses pacientes tendem a apresentar anticorpos anti-GQ1B positivos e cérebro normal de ressonância magnética (13). Como tal, sentimos que um diagnóstico alternativo é mais provável. Embora o NMOSD possa apresentar lesões inflamatórias próximas ao pontine tegmentum, elas são caracteristicamente um pouco mais baixas no assoalho do quarto ventrículo. Estes casos aqui relatados não preenchem os critérios recentemente atualizados para NMOSD (16).
Simplesmente, a síndrome CLIPPERS é um distúrbio inflamatório do tronco cerebral, mas é clinica e radiologicamente mais difusa e improvável de ser uma explicação em nossos pacientes (17).
O controle do olhar vertical é geralmente atribuído ao cérebro médio rostral, o núcleo intersticial rostral do MLF (riMLF) contendo células estouradas, e o núcleo intersticial de Cajal formando o integrador neural para manutenção da posição na órbita. Estas regiões projetam-se bilateralmente, em parte através da comissura posterior. As entradas para estas áreas derivam de várias fontes, em parte dependentes do tipo de entrada.
Ingressos vertebulares derivam dos núcleos vestibulares superiores bilateralmente, enquanto os sinais de busca suave projetam-se do grupo Y de células para a riMLF. As vias incluem o MLF, o tracto tegmental ventral e as vias cerebelares. Sacadas verticais voluntárias e reflexas, determinadas por redes supratentoriais, parecem depender de projeções da região PPRF bilateralmente e são abolidas por lesões localizadas do PPRF caudal apenas bilateralmente (18). Uma forte projeção do neurônio omnipausa tem sido demonstrada a partir do PPRF, bilateralmente, para o riMLF (19, 20). Estes devem ser inibidos para que sejam geradas sacadas voluntárias e reflexivas, não fases rápidas (21).
Olhar vertical pode ser poupado na presença de oftalmoplegia horizontal com lesão tegmental pontina posterior com ou sem patologia mais disseminada (1, 13). Embora as lesões abdominais puras possam produzir paralisia horizontal do olhar, os casos relatados por Milea et al. apresentaram precocemente INO bilateral, sugerindo envolvimento do MLF ou projeções bilaterais no MLF.
A lesão unificadora, em nossos pacientes e naqueles aqui referenciados, é a lesão tegmental posterior. Esta lesão está muito próxima dos núcleos seqüestrados e do FRPM contendo as células de ruptura excitatória para o olhar horizontal. O envolvimento bilateral das projeções do PPRF ou dos núcleos abdutores explicaria a paralisia do olhar horizontal. A relativa economia de movimentos verticais dos olhos implica que os sinais verticais bilaterais que se projetam para o centro do olhar vertical de formação reticular mesencéfalo através do MLF (22), percorrem um caminho distinto nas pons, em comparação com as entradas do olhar lateral. Isto é consistente com as evidências de Pierrot-Deseilligny et al. (7), sobre paralisia do olhar horizontal bilateral dissociado, mas em desacordo com a percepção clínica convencional atual da anatomia nesta área.
Se existem lesões bilaterais dos centros de visão lateral no FRPM, intimamente associadas e quase indistinguíveis do núcleo abdutor, a sabedoria convencional indicaria que deveria haver paralisia do olhar vertical também, uma vez que essas vias são ditas para correr juntas. Certamente, lesões da linha média que afetam ambos os fasciculi longitudinais medianos (MLF) produzem INO bilaterais, caracteristicamente associados à paresia vertical do olhar, caracterizados por deficiência da perseguição vertical lisa e cancelamento do reflexo vestíbulo-ocular (23). Mais lesões rostrais podem afetar as estruturas do cérebro médio (riMLF e INC) envolvidas nas sacadas verticais (24). Não há comprometimento do olhar vertical em nossos pacientes.
Sugerimos que as vias verticais e horizontais do olhar passem separadamente pelo seu curso inferior e se fundam no seu curso rostral, com as entradas verticais do olhar correndo anterolaterais às entradas horizontais do olhar. Elas podem cruzar-se na sua subida, provavelmente substancialmente, de tal forma que lesões bilaterais são necessárias para produzir a paralisia vertical do olhar. Isto explicaria a economia da via direta para o olhar vertical a partir do PPRF lateral na presença de uma lesão unilateral, abolição dos movimentos oculares verticais com lesões bilaterais localizadas e a exigência de estimulação bilateral para provocar movimentos oculares verticais (18, 22).
Propomos uma disposição anatômica ligeiramente alterada para representar isto (Figura 2). As vias horizontais do olhar projetam-se para o núcleo ipsilateral abduzido e depois sobem no MLF para o sub-núcleo do reto medial contralateral do terceiro núcleo nervoso. Propomos que o sinal do olhar vertical projeta-se mais anteriormente para o MLF e, pelo menos a uma curta distância, é separável das vias de fibra do olhar horizontal.
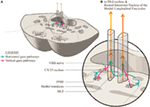
Figure 2. (A) Uma secção através dos médios-pontes mostrando a relação da formação reticular paramediana pontina com o fasciculus longitudinal mediano (MLF) e o sétimo nervo craniano adjacente enquanto varre ao redor do núcleo abdutor. (B) Uma ampliação mostrando a conformação proposta das trajetórias dos olhares horizontal e vertical separados enquanto se projetam para o MLF. O sinal horizontal decussifica ao nível dos pons e ascende no MLF contralateral, enquanto é incerto se o sinal do olhar vertical decussifica ou é uma projeção direta.
As semelhanças no fenótipo e na morfologia das lesões causais nestes casos sugerem que esta região do tegmento pontino pode ter características particulares tornando-o suscetível ao ataque imunológico. Nenhum destes casos preenche os critérios para outras doenças, inflamatórias ou não, associadas ao envolvimento de MLF.
Se de facto estes casos representam um fenótipo novo, então existe a necessidade de discernir o curso óptimo do tratamento, tanto durante a fase aguda como a longo prazo. O diagnóstico incorrecto, por exemplo com EM ou AVC, corre o risco de expor o paciente a um tratamento antiplaquetário ou imunomodulatório desnecessário a longo prazo e à ansiedade em torno do diagnóstico de uma condição significativa, potencialmente recorrente a longo prazo, com impacto adverso associado nas suas escolhas e opções de vida.
Identificação de outros casos deste fenótipo seria útil para facilitar a busca de novos anticorpos específicos que possam estar em jogo aqui e para elucidar o curso de tratamento mais apropriado e eficaz.
Contribuições dos Autores
RE reviram os arquivos e imagens do paciente, coletaram os dados e construíram as apresentações preliminares, além de contribuir para a edição contínua do manuscrito final submetido. OW supervisionou o RE na coleta dos dados e esteve envolvido em todos os níveis de escrita e interpretação dos dados, bem como na revisão e edição do manuscrito final aqui apresentado. OW trabalhou com RE na análise dos dados, na revisão da literatura relevante, na interpretação dos resultados e na preparação do manuscrito.
Conflict of Interest Statement
Esta pesquisa não foi apoiada financeiramente por nenhum interesse comercial. Não há relações financeiras que possam ser interpretadas como um potencial conflito de interesses.
1. Milea D, Napolitano M, Dechy H, Le Hoang P, Delattre J-Y, Pierrot-Deseilligny C. Paralisia total do olhar horizontal bilateral, revelando esclerose múltipla. J Neurol Neurosurg Psychiatry (2001) 70(2):252-5. doi:10.1136/jnnp.70.2.252
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Tan E, Kansu T. Paralisia bilateral horizontal do olhar em esclerose múltipla. J Clin Neuroophthalmol (1990) 10(2):124–6.
Google Scholar
3. Kataoka S, Hori A, Shirakawa T, Hirose G. Paramedian pontine infarction. Stroke (1997) 28(4):809–15. doi:10.1161/01.STR.28.4.809
CrossRef Full Text | Google Scholar
4. Furutani Y, Hata M, Miyamoto K, Moribata Y, Yoshimura N. A case of neuromyelitis optica masquerading as Miller Fisher syndrome. Case Rep Neurol (2014) 6(3):226–31. doi:10.1159/000368183
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Ng AW, Teoh SC. Dengue eye disease. Surv Ophthalmol (2015) 60(2):106–14. doi:10.1016/j.survophthal.2014.07.003
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Koehler PJ, Wattendorff AR, Goor C, Hekster REM, Falke THM. Bilateral horizontal gaze paralysis due to pontine hemorrhage. Clin Neurol Neurosurg (1986) 88(2):121–5. doi:10.1016/S0303-8467(86)80007-5
CrossRef Full Text | Google Scholar
7. Pierrot-Deseilligny C, Goasguen J, Chain F, Lapresle J. Pontine metastasis with dissociated bilateral horizontal gaze paralysis. J Neurol Neurosurg Psychiatry (1984) 47(2):159–64. doi:10.1136/jnnp.47.2.159
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Henderson S. A young patient with visual disturbance. Eur J Intern Med (2014) 25(6):e69–70. doi:10.1016/j.ejim.2014.05.007
CrossRef Full Text | Google Scholar
9. Matsui TA, Mineta H, Shioyama S, Kihara M, Takahashi M. . Clin Neurol (1998) 38(2):150–3.
Google Scholar
10. Bickerstaff ER. Brain-stem encephalitis; further observations on a grave syndrome with benign prognosis. Br Med J (1957) 1(5032):1384–7. doi:10.1136/bmj.1.5032.1384
CrossRef Full Text | Google Scholar
11. Schaefer PW, Grant PE, Gonzalez RG. Diffusion-weighted MR imaging of the brain. Radiology (2000) 217(2):331–45. doi:10.1148/radiology.217.2.r00nv24331
CrossRef Full Text | Google Scholar
12. Küker W, Ruff J, Gaertner S, Mehnert F, Mader I, Nägele T. Ferramentas modernas de ressonância magnética para caracterização de lesões desmielinizantes agudas: valor de deslocamento químico e imagem ponderada por difusão. Neuroradiology (2004) 46(6):421-6. doi:10.1007/s00234-004-1203-5
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Kipfer S, Crook DW. Paralisia bilateral horizontal isolada do olhar como primeira manifestação de esclerose múltipla. Mult Scler J (2014) 20(6):754-5. doi:10.1177/1352458513518627
CrossRef Full Text | Google Scholar
14. Bronstein AM, Rudge P, Gresty MA, Du Boulay G, Morris J. Anormalidades do olhar horizontal. Achados clínicos, oculográficos e de ressonância magnética. II. Paralisia dos olhos e oftalmoplegia internuclear. J Neurol Neurosurg Psychiatry (1990) 53(3):200–7. doi:10.1136/jnnp.53.3.200
CrossRef Full Text | Google Scholar
15. Wingerchuk DM, Lennon VA, Pittock SJ, Lucchinetti CF, Weinshenker BG. Revised diagnostic criteria for neuromyelitis optica. Neurology (2006) 66(10):1485–9. doi:10.1212/01.wnl.0000216139.44259.74
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Wingerchuk DM, Banwell B, Bennett JL, Cabre P, Carroll W, Chitnis T, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology (2015) 85:177–89. doi:10.1212/WNL.0000000000001729
CrossRef Full Text | Google Scholar
17. Kira J. The expanding phenotype of CLIPPERS: is it a disease or a syndrome? J Neurol Neurosurg Psychiatry (2012) 83(1):2–3. doi:10.1136/jnnp-2011-301626
CrossRef Full Text | Google Scholar
18. Henn V, Lang W, Hepp K, Reisine H. Experimental gaze palsies in monkeys and their relation to human pathology. Brain (1984) 107(2):619–36. doi:10.1093/brain/107.2.619
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Büttner-Ennever JA, Buttner U. A cell group associated with vertical eye movements in the rostral mesencephalic reticular formation of the monkey. Brain Res (1978) 151(1):31–47. doi:10.1016/0006-8993(78)90948-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Horn AKE. The reticular formation. Prog Brain Res (2006) 151:127–55. doi:10.1016/S0079-6123(05)51005-7
CrossRef Full Text | Google Scholar
21. Nakao S, Shiraishi Y, Oda H, Inagaki M. Direct inhibitory projection of pontine omnipause neurons to burst neurons in the Forel’s field H controlling vertical eye movement-related motoneurons in the cat. Exp Brain Res (1988) 70(3):632–6. doi:10.1007
CrossRef Full Text | Google Scholar
22. Bender MB. Brain control of conjugate horizontal and vertical eye movements: a survey of the structural and functional correlates. Brain (1980) 103(1):23–69. doi:10.1093/brain/103.1.23
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ranalli PJ, Sharpe JA. Vertical vestibulo-ocular reflex, smooth pursuit and eye-head tracking dysfunction in internuclear ophthalmoplegia. Brain (1988) 111(Pt 6):1299–317.
PubMed Abstract | Google Scholar
24. Bhidayasiri R, Plant GT, Leigh RJ. A hypothetical scheme for the brainstem control of vertical gaze. Neurology (2000) 54(10):1985–93.
PubMed Abstract | Google Scholar