H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
H2S Lewis Structure
A estrutura de Lewis de qualquer composto é uma representação estrutural dos electrões de valência que participam na formação da ligação juntamente com os pares de electrões sem ligação. Conhecer a estrutura de Lewis de um dado composto químico é essencial, pois fornece a informação necessária sobre todas as outras propriedades químicas do composto.
A representação é apresentada utilizando pontos e linhas que representam os electrões. Os pontos representam os elétrons que não participam da formação da ligação. Já as linhas representam as ligações no composto. A estrutura é feita com base na Regra do Octeto. A Regra do Octeto de Química afirma que devem existir oito elétrons no invólucro externo de um elemento para que ele seja estável.
A Estrutura de Lewis de Sulfato de Hidrogênio é fácil de desenhar e entender. Neste composto, ambos os átomos de hidrogênio requerem um elétron para fazer a ligação covalente com o enxofre. A estrutura de Lewis do H2S é similar à do H2S. O enxofre precisa de oito elétrons para preencher os requisitos para a Regra do Octeto. Mas o Hidrogénio necessita apenas de um electrão para se tornar estável pois pertence ao Grupo 1 elementos.
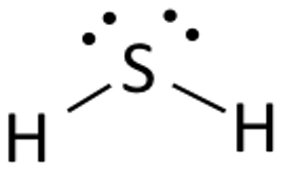
Colocar o átomo de Enxofre no meio e dispor os seus electrões de valência à sua volta.
Agora coloque dois átomos de Hidrogénio em ambos os lados do átomo central.
Aqui os electrões de valência de Enxofre são usados para tornar o Hidrogénio estável doando um electrão a ambos os átomos de Hidrogénio. Dois dos seis elétrons de valência participam da formação de ligações.
Linhas de desenho (para mostrar ligações) entre os átomos de Hidrogênio e de Enxofre.
Os quatro elétrons restantes são elétrons sem ligação e por isso são exibidos como pontos próximos ao átomo de Enxofre. No total há dois pares de elétrons sem ligação neste composto e os átomos de Hidrogênio têm uma concha de valência completa.
H2S Hibridação
Para compreender a hibridação do H2S, é vital saber duas coisas primeiro:
- O número de ligações no composto e o seu tipo
É essencial saber o tipo de ligação no composto para conhecer a sua hibridação. Na molécula de H2S, dois átomos de hidrogênio formam uma ligação com o átomo central de enxofre. Duas ligações simples são formadas na molécula. Estas ligações absorvem quatro elétrons de valência e, portanto, restam outros quatro elétrons de valência. Ao formar uma ligação o orbital do átomo de Hidrogênio se sobrepõe ao orbital p do átomo de Enxofre. O par único de elétrons ocupa dois dos orbitais sp3. Os outros dois orbitais do sp3 sobrepõem-se com o orbital 1s do átomo de Hidrogênio.
Este arranjo leva à hibridação sp3 da molécula H2S. A sobreposição dos orbitais de duas hibridações forma duas ligações sigma entre o átomo de Hidrogênio e o de Enxofre.
- O número estéreo do composto dado
O número estéreo é definido como a região da densidade de elétrons vista ao redor do átomo central. Neste caso, como o enxofre é o átomo central, o número estéreo do composto será o total cumulativo de átomos ligados ao átomo central e o número de pares solitários de elétrons ao redor do átomo central.
A fórmula para encontrar este número é:
Número Estérico (SN)
= No de ligações sigma no átomo central + No de pares solitários pi no átomo central
Neste caso de moléculas H2S, há duas ligações sigma, e há dois pares solitários de elétrons no átomo central.

Thus SN de molécula de H2S = 2+2
=4
Como o número Estéreo de H2S é quatro, tem dois
orbitais híbridos e dois pares solitários de elétrons que fazem dele uma hibridização sp3.
Agora que conhecemos a estrutura de Lewis e hibridação da molécula, é fácil determinar a sua geometria molecular.
Geometria molecular H2S
Hibridação da molécula H2S é sp3; o átomo de Enxofre está em ligação central com dois átomos de Hidrogénio formando o ângulo de ligação inferior a 180 graus. De acordo com a teoria VSEPR, os pares solitários de elétrons se repelem, mas como o átomo de Enxofre é menos eletro-negativo, o ângulo de ligação diminui para 104,5 graus.
Esta diminuição no ângulo leva a uma estrutura dobrada.
Outra forma de conhecer a geometria molecular é pelo método AXN. Onde A denota o átomo central, X é para o par de elétrons ligado ao número e N é para o par de elétrons solitário. Aqui a fórmula geral será AX2N2 devido a dois pares de ligação e dois pares solitários de elétrons. Assim esta molécula mostra uma geometria dobrada.
H2S Polaridade
Agora que temos a informação necessária sobre a molécula, é fácil de determinar a sua polaridade. A polaridade de uma determinada molécula depende da sua geometria molecular e da eletronegatividade geral. Como o átomo de enxofre é menos electronegativo, a electronegatividade global do composto é inferior a 0.4, o que o torna não-polar.
Assim pode-se dizer que a molécula de H2S é não-polar.
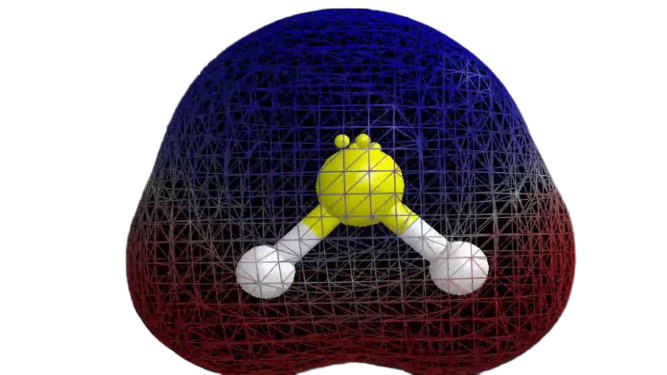
Observações finais
Das informações acima, pode-se concluir que a molécula de H2S tem oito elétrons de valência, hibridação sp3, geometria molecular dobrada e é não-polar.