Princípios de Biologia
Após aprender que as reações químicas liberam energia quando as ligações de armazenamento de energia são rompidas, uma próxima questão importante é a seguinte: Como a energia associada a essas reações químicas é quantificada e expressa? Como a energia liberada de uma reação pode ser comparada com a de outra reação? Uma medida da energia livre é usada para quantificar estas transferências de energia. Lembre-se que, de acordo com a segunda lei da termodinâmica, todas as transferências de energia envolvem a perda de alguma quantidade de energia de uma forma inutilizável, como o calor. A energia livre refere-se especificamente à energia associada a uma reacção química que está disponível após as perdas serem contabilizadas. Em outras palavras, a energia livre é energia utilizável, ou energia que está disponível para fazer trabalho. Olhando para este conceito num sentido biológico, energia livre é a energia dentro de uma molécula que pode ser usada para realizar trabalho. A glicose tem muita energia livre porque há muita energia armazenada dentro das ligações da molécula de glicose. O dióxido de carbono tem uma energia livre muito menor porque há muito menos energia armazenada em suas ligações.
Se a energia é liberada durante uma reação química, então a mudança na energia livre da conversão dos reagentes aos produtos, significada como ΔG (delta G) será um número negativo. Uma mudança negativa na energia livre também significa que os produtos da reação têm menos energia livre do que os reagentes, porque liberam alguma energia livre durante a reação. Reações que têm uma mudança negativa na energia livre e conseqüentemente liberam energia livre são chamadas reações exergônicas. Pense: exergonic significa que a energia exergônica está saindo do sistema. Estas reacções também são referidas como reacções espontâneas, e os seus produtos têm menos energia armazenada do que os reagentes. Uma distinção importante deve ser feita entre o termo espontâneo e a ideia de uma reacção química que ocorre imediatamente. Ao contrário do uso diário do termo, uma reação espontânea não é aquela que ocorre repentina ou rapidamente. A oxidação do ferro é um exemplo de uma reação espontânea que ocorre lentamente, pouco a pouco, ao longo do tempo.
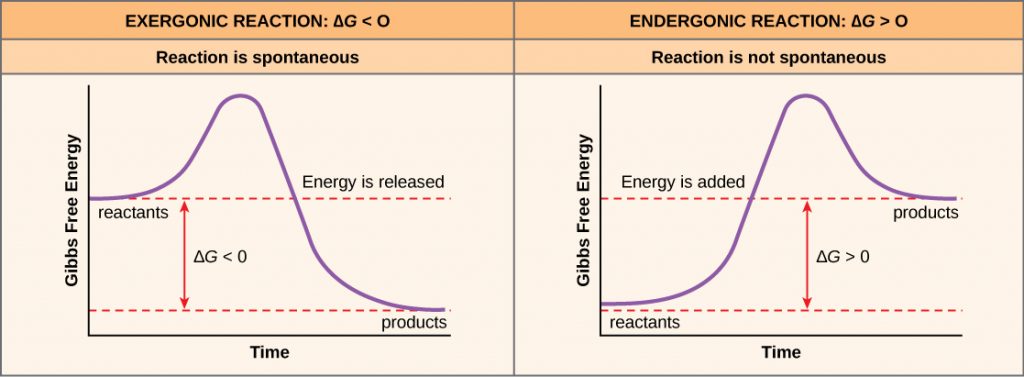
Se uma reação química absorve energia em vez de liberar energia em equilíbrio, então o ΔG para essa reação será um valor positivo. Neste caso, os produtos têm mais energia livre do que os reagentes. Assim, os produtos destas reacções podem ser pensados como moléculas armazenadoras de energia. Estas reacções químicas são chamadas reacções endergónicas e são não espontâneas.
Uma reacção endergónica não terá lugar por si só sem a adição de energia livre.

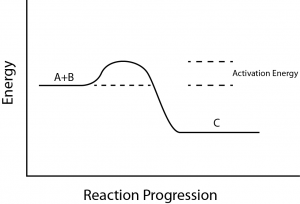
Há outro conceito importante que deve ser considerado em relação às reações endergônicas e exergônicas. Reacções exergónicas requerem uma pequena quantidade de energia para se iniciarem, antes de poderem prosseguir com os seus passos de libertação de energia.
Estas reacções têm uma libertação líquida de energia, mas ainda requerem alguma energia no início. Esta pequena quantidade de energia necessária para que todas as reações químicas ocorram é chamada energia de ativação (Figura 3).
sem notar, as imagens desta página estão licenciadas sob CC-BY 4.0 por OpenStax.
Texto adaptado de: OpenStax, Concepts of Biology. OpenStax CNX. 18 de Maio, 2016 http://cnx.org/contents/[email protected]