Projectos de Ciência para Principiantes: Química
Chemistry
Sal ou Açúcar: Que Dissolve Mais Rapidamente em Diferentes Líquidos
Soluções não são mais do que misturas de diferentes compostos ou elementos. Você encontra soluções todos os dias sem sequer perceber.
O ar que você respira?que contém água?é uma solução de um líquido e um gás. Se você bebeu um refrigerante hoje, você realmente bebeu a solução de um gás dissolvido em água com sabor. Se você está usando uma pulseira feita de prata esterlina, você está usando uma solução de dois metais.
Neste experimento, você estará trabalhando com uma solução líquida, que é um dos três tipos de soluções. Os outros tipos são soluções gasosas e soluções sólidas.
Então o que parece ser o problema?
Um soluto é a substância?ou um sólido, líquido ou gás?que se dissolve. Um solvente?que também pode ser um sólido, líquido ou gás?é a substância que faz a dissolução. Uma solução é uma mistura uniforme de um soluto (geralmente um sólido) dissolvido num solvente (geralmente um líquido).
Quando se mistura uma colher de açúcar num copo de água, está-se a formar uma solução. Este tipo de solução líquida é composta por um soluto sólido, que é o açúcar, e um solvente líquido, que é a água. Como as moléculas de açúcar se espalham uniformemente pela água, o açúcar dissolve.
Misturar um líquido num gás faz outro tipo de solução, chamada solução gasosa. Um exemplo deste tipo de solução é a humidade. A umidade é água (um líquido) dissolvido no ar (um gás).
P>Pense em como um cubo de açúcar se dissolve na água, em comparação com um pacote de açúcar solto. O cubo dissolve-se mais lentamente porque menos moléculas de açúcar estão inicialmente em contacto com a água.
Em uma solução sólida, como a prata esterlina, o cobre que foi aquecido a altas temperaturas é misturado com a prata que também foi aquecida até derreter. O cobre é o soluto, que é a substância que se dissolverá no solvente. A prata é o solvente.
O tipo de solução é determinado pelo estado da matéria do solvente. Se a substância que faz a dissolução for um líquido, a solução é chamada solução líquida. Se o solvente for um gás, a solução é chamada de solução gasosa. E você adivinhou bem: Um solvente sólido formará uma solução sólida.
P>P>Pode verificar o tamanho dos cristais de sal e açúcar sob um microscópio ou lupa, o que lhe permitirá ver as suas formas, também. Se você desenhar o que você vê, usando um lápis para que você possa ilustrar o sombreado, você pode incluir a ilustração como parte da exibição final do seu projeto da feira de ciências.
Há alguns fatores que geralmente aumentam a quantidade de soluto que pode ser dissolvido. Se você quiser dissolver mais açúcar na mesma quantidade de água, por exemplo, você pode aquecer a água. Também pode moer o açúcar em partículas mais pequenas para aumentar a sua superfície, ou pode agitar a mistura.
Nos anos em que tem usado sal e açúcar nos seus alimentos, provavelmente já reparou que cada pedaço de sal?que na verdade é um cristal?é um pouco menor que cada pedaço de açúcar, que também é um cristal.
Uma molécula é dois ou mais elementos que são quimicamente combinados. Uma molécula de sal contém sódio e cloro, que são quimicamente combinados para fazer cloreto de sódio. A fórmula química para este sal é NaCl. Uma molécula de açúcar contém carbono, hidrogênio e oxigênio. A fórmula química para o açúcar é C12H22O11.
O problema que você vai tentar resolver nesta experiência é se o açúcar ou o sal se dissolve mais rapidamente quando misturado em vários líquidos. O tamanho das peças afecta a rapidez com que se misturam com o líquido?
Quando se dissolve açúcar ou sal num líquido?digamos, água?o que acontece é que as moléculas de açúcar se movem para se encaixarem entre as moléculas de água dentro de um copo ou copo. A ilustração abaixo mostra como as diferentes moléculas estão dispostas no recipiente.
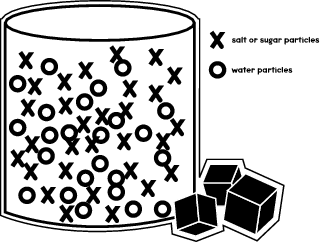
Na sua experiência, verá como as moléculas de sal e açúcar se movem dentro de diferentes líquidos e se dissolvem a diferentes velocidades.
O título desta secção, ?Sal ou Açúcar: Que Dissolve Mais Rapidamente em Diferentes Líquidos?? pode servir como título do seu projeto, se você quiser. Você também pode considerar um dos seguintes títulos para o seu projeto:
- The Great Salt vs. Sugar Dissolving Contest
- Using Sal and Sugar to Explore How Substances Dissolve
O nome que você escolher está bem. Vamos dedicar um minuto para considerar porque este projecto é um uso valioso do seu tempo.
Qual é o Ponto?
Quando há um espaço amplo entre as moléculas de um solvente, diz-se que o solvente é insaturado. Quando muito soluto foi dissolvido no solvente, mas ainda há algum espaço entre as moléculas, a solução é concentrada. Quando absolutamente nenhum outro soluto pode ser dissolvido dentro de um solvente, a solução é saturada.
E quando o excesso de soluto foi dissolvido por aquecimento da solução, diz-se que é supersaturada.
O objectivo desta experiência, para além de aprender se o sal ou o açúcar se dissolvem mais rapidamente em vários líquidos, é aprender como as moléculas interagem numa solução.
Como viu na ilustração anterior, as moléculas de água ocupam a maior parte do espaço no recipiente. Mas ainda há algum espaço disponível no qual as moléculas de açúcar ou sal podem caber. Através da sua experiência, você aprenderá quão rápido as moléculas de açúcar cabem nesses espaços, em comparação com as partículas de sal.
Sabendo que isto o ajudará a compreender melhor o processo que ocorre quando uma substância se dissolve.
O controle na sua experiência será a água. Os outros líquidos nos quais você dissolve sal e açúcar serão as variáveis.
| Controles: | Solvente?água |
| /td>>Solutos?açúcar, sal | |
| Cinco líquidos transparentes diferentes (podem ser coloridos) |
Lembrar quando conduzir a sua experiência que é muito importante que os líquidos que você usa sejam todos da mesma temperatura. Você já aprendeu que o açúcar se dissolve mais rapidamente num líquido quente do que num líquido frio, por isso sabe que não seria uma experiência precisa se alguns dos líquidos que você usa fossem quentes e outros frios. A temperatura do líquido tornar-se-ia uma variável.
Por isso, todos os líquidos que utiliza?incluindo a água?devem estar à temperatura ambiente. Se os mantiver normalmente no frigorífico, não se esqueça de os deixar ficar no balcão durante a noite até estarem todos à mesma temperatura.
Para lhe dar um pouco mais de flexibilidade quando fizer a experiência, pode escolher os líquidos em que vai dissolver açúcar e sal. Não faz sentido ter de sair e comprar líquidos adicionais se já tiver o que precisa.
Não assuma que os líquidos que têm estado sentados em áreas diferentes da sua casa estão à mesma temperatura. Uma garrafa de refrigerante que tenha estado sentada na garagem, por exemplo, pode estar vários graus mais fresca do que esfregar álcool do armário do banheiro, ou suco de maçã da despensa da cozinha. Certifique-se de ter todos os líquidos no mesmo local para que eles atinjam a mesma temperatura ambiente. If you don’t, the results of your experiment won’t be valid.
Just make sure you choose liquids that are different from each other in taste, color, odor, and purpose. You’ll also need to select those that allow you to observe the salt and sugar as it dissolves. If you use milk or orange juice, for example, you won’t be able to watch the salt and sugar dissolve. Some suggestions for liquids to consider are:
- White vinegar
- Club soda
- Ginger ale
- Glass cleaner (such as Windex)
- Lemonade
- Tea or iced tea (each at room temperature)
- Apple juice
- Rubbing alcohol
All of these are commonly found around the house, perhaps saving you a trip to the store.
What Do You Think Will Happen?
Agora você sabe como as soluções são formadas e alguns dos fatores que irão afetar a velocidade com que o açúcar e o sal que você vai usar se dissolverão, você deve ser capaz de fazer um bom palpite sobre qual deles se dissolverá mais rápido.
Se ainda não fez esta experiência, não saberá se os líquidos que vai utilizar serão um factor de dissolução do sal e do açúcar. Isto torna mais difícil a formação de uma hipótese, mas não se preocupe. Se a sua hipótese se revelar correcta, ou não, não afecta a validade ou o resultado da sua experiência.
Embora só saiba depois da sua experiência se as propriedades dos diferentes líquidos que escolher irão afectar a taxa de dissolução do sal e do açúcar, sabe que os cristais de sal são geralmente mais pequenos do que os cristais de açúcar. E você sabe que a temperatura dos líquidos não será um fator em sua experiência.
Tente usar suas experiências passadas, as informações que leu anteriormente nesta seção, e seu bom senso para chegar a uma boa hipótese.
Remmbre-se que sua hipótese deve ser declarada como uma frase objetiva, não uma pergunta. Por isso, vá em frente e -faça o seu palpite se o sal ou o açúcar se dissolverão mais rapidamente, e vamos começar com o experimento.
Materiais necessários para este projeto
Alguns líquidos sugeridos para uso neste experimento são vinagre branco, club soda, ginger ale, limpador de vidros, álcool para esfregar, suco de maçã, limonada e chá. Se você quiser substituir outro líquido por um ou mais dos líquidos sugeridos, tudo bem. Basta ter certeza de que todos os líquidos estão limpos e à temperatura ambiente.
As quantidades de materiais listados abaixo são suficientes para você conduzir a experiência três vezes com cada líquido. You’ll need:
- 12 clear, plastic cups (10 ounce )
- One permanent marker
- One (1 teaspoon) (5.0 ml) measuring spoon
- One (12 teaspoon) (2.5 ml) measuring spoon
- One (1 cup) (240 ml) measuring cup
- 8 teaspoons (40 ml) salt, divided in 16 (12 teaspoon) portions
- 8 teaspoons (40 ml) sugar, divided in 16 (12 teaspoon) portions
- 48 ounces (1,440 ml) water at room temperature
- 24 ounces (720 ml) each of five different, clear liquids, all at room temperature
- One clock or watch with a second hand
- One clear plastic cup containing eight fluid ounces (240 ml) water at room temperature
Remember to make sure that all liquids are at room temperature.
Conducting Your Experiment
When you’ve gathered all your materials, you’ll be ready to begin your experiment. Basta seguir estes passos:
P>Cerve uma chávena de água à vista para que a possa comparar com as chávenas que contêm sal e açúcar. Será interessante observar como as aparências dos líquidos mudam à medida que o sal e o açúcar se dissolvem.
Vai demorar um pouco para que o açúcar e o sal se dissolvam. Para melhores resultados, não agitar as soluções, pois ao fazê-lo apresentará uma variável adicional. Se tiver que mexer, mexa cada solução três vezes, e pare. Só mexa depois de notar que há solução no fundo de cada um dos dois recipientes. Agitar as soluções de forma desigual fará com que a sua experiência seja inválida.
- Usando o marcador permanente, escreva ?sal? em seis dos copos de plástico, e ?açúcar? nos outros seis.
- Coloque 1/2 colher de chá (2,5 ml) de sal em cada uma das seis chávenas rotuladas como ?sal’.
- Coloca 1/2 colher de chá (2,5 ml) de açúcar em cada uma das seis chávenas rotuladas como ?açúcar?
- Adicione 8 onças (240 ml) de água a uma chávena contendo sal, e uma chávena contendo açúcar. Registre imediatamente a hora em que a água foi adicionada em um gráfico de dados semelhante ao mostrado na próxima seção, “Keeping Track of Your Experiment”.
- Observe os solutos (sal e açúcar) que se dissolvem no solvente (água). Registe no gráfico de dados o momento em que lhe parece que cada soluto se dissolveu completamente. Estes tempos provavelmente não serão os mesmos.
- Calcular o tempo decorrido durante o qual a dissolução ocorreu. Pegue o tempo em que a água foi adicionada aos copos e a dissolução começou, e subtraia-o do tempo em que a dissolução terminou. Isto dá-lhe os minutos totais necessários para que o sal e o açúcar se dissolvam completamente no líquido.
- Repete os passos 4 a 6, utilizando cada líquido diferente em vez da água.
- Lave, enxague, e seque bem cada uma das 12 chávenas.
- Repete os passos 2 a 8 mais duas vezes, para um total de três tentativas para cada um dos seis líquidos.
- Calcula um tempo médio de dissolução do sal e do açúcar em cada um dos seis líquidos.
Lembrar que para encontrar o tempo médio de dissolução do sal e do açúcar em cada líquido, acrescente as três vezes registadas para cada um, depois divida por três. O número que você obtém quando divide os tempos é o tempo médio.
Percentagem do tempo que leva para que o açúcar e o açúcar se dissolvam em cada líquido, depois divida-os por três.
Utilize este gráfico para registrar o tempo que leva para o açúcar e o sal dissolver.
Cartões como o seguinte podem ser usados para registrar informações para cada solvente. Basta alterar os nomes dos solventes no cabeçalho.
Certifique-se de registar os tempos à medida que avança. Não dependa da sua memória para escrevê-los depois. Vai ter muitos números quando terminar a sua experiência.
Pondo tudo junto
O que reparou nas taxas a que o sal e o açúcar se dissolveram? Você provou que a sua hipótese estava correta? Ou incorrecta? Conseguiu detectar qualquer tipo de padrão ao adicionar o sal e o açúcar aos vários líquidos? Era óbvio que o sal se dissolveu melhor e mais rapidamente em alguns líquidos, em comparação com o açúcar? Consegue pensar em alguma razão pela qual isso possa ter ocorrido?
Pensa que a natureza química do soluto e do solvente afectou as taxas de dissolução? Utilize a informação recolhida quando pesquisou o seu tópico para o ajudar a responder a estas questões.
Quanto mais souber sobre o seu projecto, mais capaz estará de analisar correctamente os seus dados e chegar a uma conclusão sólida.
Outras investigações
Como mencionado anteriormente, os fatores que afetam a solubilidade dos solutos sólidos são:
- Aumentando ou diminuindo a temperatura do solvente
- Aumentando a área de superfície do soluto
- Stirring
Se você quisesse levar este projeto um ou dois passos adiante, você poderia projetar um experimento que testaria um?ou talvez todas?todas estas variáveis.
Poderia facilmente comparar a taxa a que os cubos de açúcar se dissolvem no líquido com a taxa de dissolução do açúcar granulado.
ou você poderia usar o mesmo soluto?digamos, açúcar?e testar se a agitação da solução fez com que ela se dissolvesse mais rapidamente. Aquecimento e resfriamento do solvente à medida que você adiciona o mesmo soluto também seria uma possibilidade de mais experiências.
Se você está curioso e disposto a experimentar, provavelmente pode pensar em muitas variações para este projeto. E, como o experimento exige apenas materiais comuns e baratos, você deve ser capaz de experimentar de acordo com o seu coração.
Excerpted from The Complete Idiot’s Guide to Science Fair Projects 2003 by Nancy K. O’Leary and Susan Shelly. Todos os direitos reservados, incluindo o direito de reprodução no todo ou em parte em qualquer forma. Usado por acordo com a Alpha Books, membro do Penguin Group (USA) Inc.
Para encomendar este livro diretamente da editora, visite o site do Penguin USA ou ligue para 1-800-253-6476. Você também pode comprar este livro na Amazon.com e Barnes & Noble.