Química para Não-Majores
Objectivos de Aprendizagem
- Definir raio atómico.
- Descrever como o atómico muda dentro de um período.
- Describe como o raio atómico muda dentro de um grupo.
Como é que todas estas pessoas cabem num espaço tão pequeno?
 Eventos atraem um grande número de pessoas para eles. Mesmo um evento ao ar livre pode encher-se para que não haja espaço para mais pessoas. A capacidade da multidão depende da quantidade de espaço no local, e a quantidade de espaço depende do tamanho dos objectos que o preenchem. Podemos colocar mais pessoas num determinado espaço do que podemos elefantes, porque os elefantes são maiores do que as pessoas. Podemos colocar mais esquilos nesse mesmo espaço do que podemos colocar pessoas pelo mesmo motivo. Saber o tamanho dos objectos com que estamos a lidar pode ser importante para decidir quanto espaço é necessário.
Eventos atraem um grande número de pessoas para eles. Mesmo um evento ao ar livre pode encher-se para que não haja espaço para mais pessoas. A capacidade da multidão depende da quantidade de espaço no local, e a quantidade de espaço depende do tamanho dos objectos que o preenchem. Podemos colocar mais pessoas num determinado espaço do que podemos elefantes, porque os elefantes são maiores do que as pessoas. Podemos colocar mais esquilos nesse mesmo espaço do que podemos colocar pessoas pelo mesmo motivo. Saber o tamanho dos objectos com que estamos a lidar pode ser importante para decidir quanto espaço é necessário.
O tamanho dos átomos é importante quando se tenta explicar o comportamento dos átomos ou compostos. Uma das formas que podemos expressar o tamanho dos átomos é com o raio atómico . Estes dados nos ajudam a entender porque algumas moléculas se encaixam e porque outras moléculas têm partes que ficam muito lotadas sob certas condições.
O tamanho de um átomo é definido pela borda de seu orbital. Contudo, os limites orbitais são difusos e na verdade são variáveis sob diferentes condições. A fim de padronizar a medida dos raios atômicos, a distância entre os núcleos de dois átomos idênticos unidos entre si é medida. O raio atómico é definido como metade da distância entre os núcleos de átomos idênticos que estão ligados entre si.

Figure 1. O raio atómico (r) de um átomo pode ser definido como a metade da distância (d) entre dois núcleos de uma molécula diatómica.
Rádios atómicos foram medidos para os elementos. As unidades para raios atómicos são picómetros, iguais a 10-12 metros. Como exemplo, a distância internuclear entre os dois átomos de hidrogênio em uma molécula de H2 é medida para ser de 74 horas. Portanto, o raio atómico de um átomo de hidrogénio é \frac{74}{2}=37\text{ pm}.
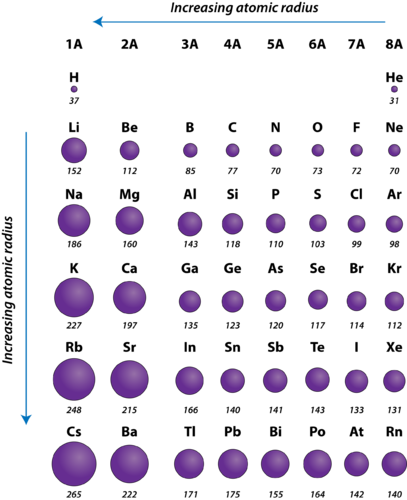
Figure 2. Raios atómicos dos elementos representativos medidos em picómetros.
Tendência Periódica
O raio atómico dos átomos diminui geralmente da esquerda para a direita ao longo de um período. Há algumas pequenas exceções, como o raio de oxigênio ser ligeiramente maior que o raio de nitrogênio. Dentro de um período, os prótons são adicionados ao núcleo à medida que os elétrons estão sendo adicionados ao mesmo nível de energia principal. Estes elétrons são gradualmente puxados para mais perto do núcleo devido ao aumento da sua carga positiva. Como a força de atração entre os núcleos e os elétrons aumenta, o tamanho dos átomos diminui. O efeito diminui à medida que se avança para a direita num período devido às repulsões electrão-electrónicas que de outra forma fariam aumentar o tamanho do átomo.
Tendência do grupo
O raio atómico dos átomos aumenta geralmente de cima para baixo dentro de um grupo. Como o número atômico aumenta para baixo em um grupo, há novamente um aumento na carga nuclear positiva. No entanto, há também um aumento no número de níveis de energia principais ocupados. Os níveis de energia principal mais elevados consistem em orbitais que são maiores em tamanho do que os orbitais de níveis de energia mais baixos. O efeito do maior número de níveis de energia principal supera o aumento da carga nuclear e, portanto, o raio atômico aumenta em um grupo.

Figure 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define “atomic radius.”
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.