10.13: Ipoteza lui Avogadro și volumul molar
Ipoteza lui Avogadro și volumul molar
Volumul este un al treilea mod de a măsura cantitatea de materie, după numărul de elemente și masă. În cazul lichidelor și al solidelor, volumul variază foarte mult în funcție de densitatea substanței. Acest lucru se datorează faptului că particulele solide și lichide sunt strânse unul lângă altul, cu foarte puțin spațiu între particule. Cu toate acestea, gazele sunt compuse în mare parte din spații goale între particulele de gaz propriu-zise (vezi figura de mai jos).
În 1811, Amadeo Avogadro a explicat că volumele tuturor gazelor pot fi determinate cu ușurință. Ipoteza lui Avogadro afirmă că volumele egale ale tuturor gazelor la aceeași temperatură și presiune conțin un număr egal de particule. Deoarece volumul total pe care îl ocupă un gaz este alcătuit în principal din spațiul gol dintre particule, dimensiunea reală a particulelor în sine este aproape neglijabilă. Un volum dat al unui gaz cu particule mici și ușoare, cum ar fi hidrogenul \(\left( \ce{H_2} \right)\) conține același număr de particule ca și același volum al unui gaz greu cu particule mari, cum ar fi hexafluorura de sulf, \(\ce{SF_6}\).
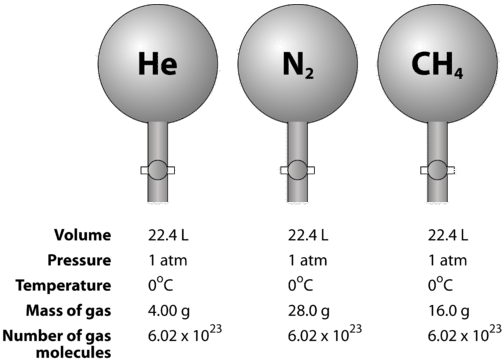
Gazele sunt compresibile, ceea ce înseamnă că, atunci când sunt supuse unei presiuni ridicate, particulele sunt forțate să se apropie unele de altele. Acest lucru diminuează cantitatea de spațiu gol și reduce volumul gazului. Volumul gazelor este, de asemenea, afectat de temperatură. Atunci când un gaz este încălzit, moleculele sale se mișcă mai repede și gazul se dilată. Din cauza variației volumului de gaz datorate schimbărilor de presiune și temperatură, compararea volumelor de gaz trebuie să se facă la o temperatură și o presiune standard. Temperatura și presiunea standard (STP) se definesc ca fiind \(0^\text{o} \text{C}\) \(\left( 273,15 \: \text{K} \right)\) și \(1 \: \text{atm}\) presiune. Volumul molar al unui gaz este volumul unui mol al unui gaz la STP. La STP, un mol (\( 6,02 \ ori 10^{23}\) particule reprezentative) de orice gaz ocupă un volum de \(22,4 \: \text{L}\) (figura de mai jos).

Figura de mai jos ilustrează modul în care volumul molar poate fi văzut atunci când se compară diferite gaze. Probele de heliu \(\left( \ce{He} \right)\), azot \(\left( \ce{N_2} \right)\) și metan \(\left( \ce{CH_4} \right)\) sunt la STP. Fiecare conține 1 mol sau \(6,02 \ ori 10^{23}\) particule. Cu toate acestea, masa fiecărui gaz este diferită și corespunde masei molare a gazului respectiv: \(4.00 \: \text{g/mol}\) pentru \(\ce{He}\), \(28.0 \: \text{g/mol}\) pentru \(\ce{N_2}\), și \(16.0 \: \text{g/mol}\) pentru \(\ce{CH_4}\).