19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- „R” group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Fiecare aminoacid diferă în ceea ce privește grupul său „R”. Grupa „R” a unui aminoacid este restul moleculei, adică partea diferită de grupa amino, grupa acidă și carbonul central. Fiecare aminoacid diferit are o grupă „R” unică, iar proprietățile chimice unice ale unui aminoacid depind de cele ale grupei sale „R” (figura \(\PageIndex{1}\)).
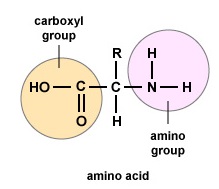
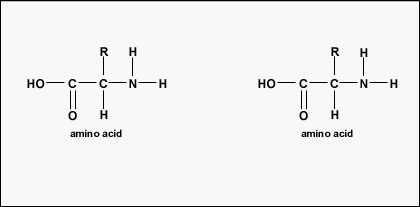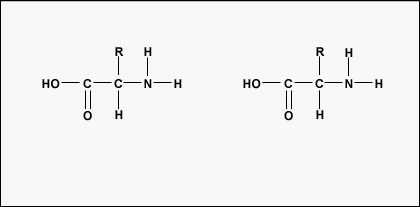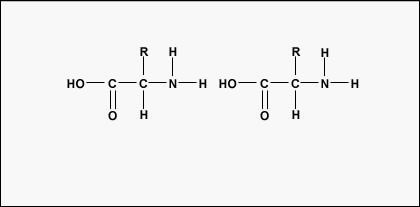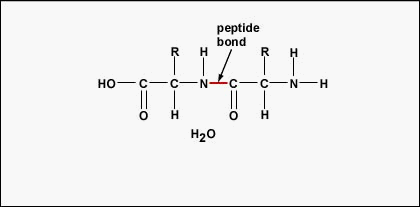
Pentru a forma polipeptide și proteine, aminoacizii sunt uniți între ei prin legături peptidice, în care gruparea amino sau NH2 a unui aminoacid se leagă de gruparea carboxil (acid) sau COOH a unui alt aminoacid, așa cum se arată în (Figura \(\PageIndex{2}\\) și Figura \(\PageIndex{3}\)).
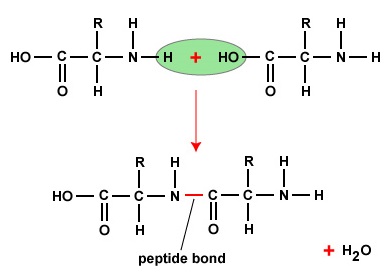
O peptidă este formată din doi sau mai mulți aminoacizi uniți între ei prin legături peptidice, iar o polipeptidă este un lanț format din mai mulți aminoacizi. O proteină conține una sau mai multe polipeptide. Prin urmare, proteinele sunt lanțuri lungi de aminoacizi ținuți împreună prin legături peptidice.
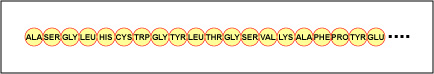
Ordinea reală a aminoacizilor din proteină se numește structura primară a acesteia (figura \(\PageIndex{4}\)) și este determinată de ADN. După cum se va vedea mai târziu în această unitate, ADN-ul este împărțit în unități funcționale numite gene. O genă este o secvență de baze dezoxiribonucleotide de-a lungul unui lanț de ADN care codifică un produs funcțional – o moleculă specifică de ARN mesager, ARN de transfer sau ARN ribozomal. Produsul este de obicei ARN mesager (ARNm), iar ARNm are ca rezultat final sinteza unei polipeptide sau a unei proteine. Prin urmare, se spune în mod obișnuit că ordinea bazelor dezoxiribonucleotide dintr-o genă determină secvența de aminoacizi a unei anumite proteine. Deoarece anumiți aminoacizi pot interacționa cu alți aminoacizi din aceeași proteină, această structură primară determină în cele din urmă forma finală și, prin urmare, proprietățile chimice și fizice ale proteinei.
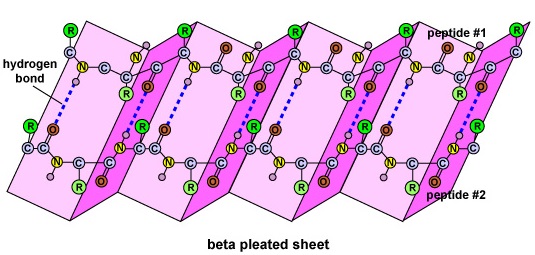
Structura secundară a proteinei se datorează legăturilor de hidrogen care se formează între atomul de oxigen al unui aminoacid și atomul de azot al altuia. Aceasta conferă proteinei sau polipeptidei forma bidimensională a unui alfa-helix sau a unei foițe beta-plecate (Figura \(\PageIndex{5}\)).
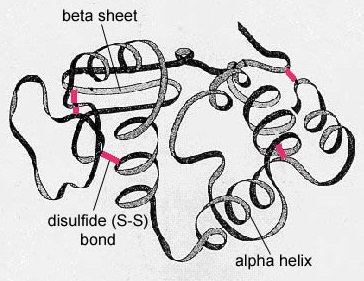
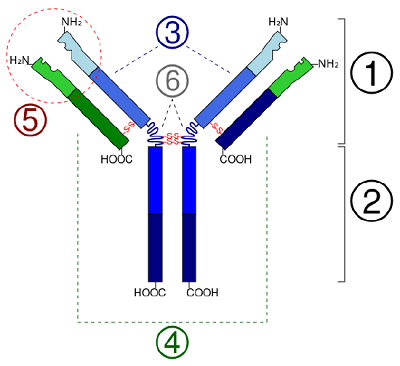
În cazul proteinelor globulare, cum ar fi enzimele, lanțul lung de aminoacizi se pliază într-o formă funcțională tridimensională sau structură terțiară. Acest lucru se datorează faptului că anumiți aminoacizi cu grupări sulfhidril sau SH formează legături disulfură (S-S) cu alți aminoacizi din același lanț. Alte interacțiuni între grupele R ale aminoacizilor, cum ar fi legăturile de hidrogen, legăturile ionice, legăturile covalente și interacțiunile hidrofobe, contribuie, de asemenea, la structura terțiară (figura \(\PageIndex{6}\)). În unele proteine, cum ar fi moleculele de anticorpi și hemoglobina, mai multe polipeptide se pot lega între ele pentru a forma o structură cuaternară (Figura \(\PageIndex{7}\)).
Așa cum se va vedea mai târziu în această unitate, în timpul sintezei proteinelor, ordinea bazelor nucleotidice de-a lungul unei gene este transcrisă într-un lanț complementar de ARNm care este apoi tradus de ARNt în ordinea corectă a aminoacizilor pentru acea polipeptidă sau proteină. Prin urmare, ordinea bazelor dezoxiribonucleotide de-a lungul ADN-ului determină ordinea aminoacizilor din proteine. Deoarece anumiți aminoacizi pot interacționa cu alți aminoacizi, ordinea aminoacizilor pentru fiecare proteină determină forma sa tridimensională finală, care, la rândul său, determină funcția acelei proteine (de ex, cu ce substrat va reacționa o enzimă, cu ce epitopi se va combina Fab-ul unui anticorp, la ce receptori se va lega o citokină).
Summary
- Aminoacizii sunt elementele constitutive ale proteinelor. Există 20 de aminoacizi diferiți care se găsesc în mod obișnuit în proteine și adesea 300 sau mai mulți aminoacizi per moleculă de proteină.
- Toți aminoacizii conțin o grupare amino sau NH2 și o grupare carboxil (acid) sau COOH.
- Pentru a forma polipeptide și proteine, aminoacizii sunt uniți între ei prin legături peptidice, în care grupul amino sau NH2 al unui aminoacid se leagă de grupul carboxil (acid) sau COOH al unui alt aminoacid.
- O peptidă este formată din doi sau mai mulți aminoacizi uniți între ei prin legături peptidice; o polipeptidă este un lanț format din mai mulți aminoacizi; iar o proteină conține una sau mai multe polipeptide. Prin urmare, proteinele sunt lanțuri lungi de aminoacizi ținuți împreună prin legături peptidice.
- Ordinea reală a aminoacizilor din proteină se numește structura primară a acesteia și este determinată de ADN.
- Ordinea bazelor dezoxiribonucleotide dintr-o genă determină secvența de aminoacizi a unei anumite proteine. Deoarece anumiți aminoacizi pot interacționa cu alți aminoacizi din aceeași proteină, această structură primară determină în cele din urmă forma finală și, prin urmare, proprietățile chimice și fizice ale proteinei.
- Structura secundară a proteinei se datorează legăturilor de hidrogen care se formează între atomul de oxigen al unui aminoacid și atomul de azot al altui aminoacid și conferă proteinei sau polipeptidei forma bidimensională a unui alfa-helix sau a unei foițe beta-plecate.
- În cazul proteinelor globulare, cum ar fi enzimele, lanțul lung de aminoacizi devine pliat într-o formă funcțională tridimensională sau structură terțiară. Acest lucru se datorează faptului că anumiți aminoacizi cu grupări sulfhidril sau SH formează legături disulfură (S-S) cu alți aminoacizi din același lanț. Alte interacțiuni între grupele R ale aminoacizilor, cum ar fi legăturile de hidrogen, legăturile ionice, legăturile covalente și interacțiunile hidrofobe, contribuie, de asemenea, la structura terțiară.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)