4. Baze tari și slabe
Baze slabe
Amonia este o bază slabă tipică. Amoniacul în sine nu conține, evident, ioni de hidroxid, dar reacționează cu apa pentru a produce ioni de amoniu și ioni de hidroxid.
Cu toate acestea, reacția este reversibilă și, la un moment dat, aproximativ 99% din amoniac este încă prezent sub formă de molecule de amoniac. Doar aproximativ 1% a produs efectiv ioni de hidroxid. O bază slabă este o bază care nu se transformă complet în ioni de hidroxid în soluție. Atunci când o bază slabă reacționează cu apa, poziția de echilibru variază de la o bază la alta. Cu cât este mai la stânga, cu atât este mai slabă baza.
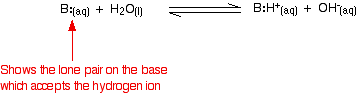
Puteți obține o măsură a poziției unui echilibru scriind o constantă de echilibru pentru reacție. Cu cât valoarea constantei este mai mică, cu atât echilibrul se află mai la stânga. În acest caz, constanta de echilibru se numește Kb. Aceasta se definește astfel:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other „p” terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |