Boala limbii
Vizualizare
Primul caz de anaplasmoză umană a fost descris în 1990, când un pacient din Wisconsin a dezvoltat o boală febrilă severă în urma unei mușcături de căpușă și a murit două săptămâni mai târziu. Frotiurile de sânge au evidențiat aglomerări de bacterii în interiorul neutrofilelor pacientului, similare cu morulae observate în monocitele cu infecție cu E. chaffeensis. Cu toate acestea, culturile și testele serologice pentru E. chaffeensis au fost negative. Cu toate acestea, evoluția clinică a pacientului a sugerat un anumit tip de ehrlichioză, iar când în anii următori au fost raportate mai multe cazuri suplimentare de boală în nordul Midwest, s-a emis ipoteza că ar putea apărea o nouă specie de Ehrlichia. Noua boală a primit provizoriu numele de „ehrlichioză granulocitară umană”, sau HGE.
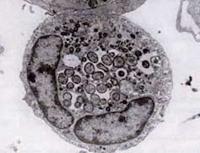
În 1994, studiile de secvențiere a ADN-ului au arătat că agentul HGE era clar distinct de E. chaffeensis, dar esențial identic cu doi agenți patogeni veterinari ehrlichiali cunoscuți anterior, E. equi și E. (Cytoecetes) phagocytophila. În cadrul unei noi scheme taxonomice puse în aplicare ulterior, aceste trei organisme au fost reunite ca o singură specie în cadrul unui nou gen, Anaplasma. Noua specie este denumită Anaplasma phagocytophilum, iar boala pe care o provoacă este cunoscută acum sub numele de anaplasmoză granulocitară umană sau HGA.
Ca și speciile de Ehrlichia, organismele Anaplasma sunt mici, gram-negative și intracelulare. A. phagocytophilum țintește neutrofilele, le alterează funcția în gazdă și formează morule în interiorul vacuolelor. Cea mai mare parte a daunelor pe care le provoacă pare să fie legată de procesele inflamatorii ale gazdei, deoarece există puține dovezi ale unei corelații între numărul de organisme și gravitatea bolii gazdei.
Anaplasmoza este o infecție globală, care apare în America de Nord, în cea mai mare parte a Europei și în estul Asiei. Căpușele din complexul Ixodes persulcatus-complex sunt vectorii: I. scapularis în regiunile din nord-estul și partea superioară a regiunii Midwest din Statele Unite; I. pacificus în nord-vestul Pacificului; I. ricinus în Europa; și I. persulcatus în Asia. A. phagocytophilum se menține în natură prin cicluri între aceste căpușe și diverse mamifere mici, în special șoareci și alte rozătoare mici. Deoarece căpușele Ixodes sunt, de asemenea, vectorii bolii Lyme, ai babesiozei și ai encefalitei transmise de căpușe, coinfecția Anaplasma cu aceste alte boli poate apărea și apare la om.
În Statele Unite, cazurile de HGA au depășit în număr pe cele de Ehrlichioză monocitară umană (HME) Similar HME și ehrlichiozei ewingii umane, vârsta medie a pacienților cu HGA este de aproximativ 50 de ani.
Semne și simptome
Cursul clinic al HGA variază de la infecția asimptomatică la boala fatală. Simptomele inițiale, care apar la aproximativ cinci până la zece zile după mușcătura de căpușă, sunt în mare parte nespecifice: febră, frisoane, cefalee severă și mialgii;j pot apărea, de asemenea, greață, tuse și artralgii. Erupțiile cutanate sunt neobișnuite, dar au fost raportate.
În comparație cu HME, HGA pare mai puțin probabil să implice sistemul nervos central, dar neuropatiile periferice (de exemplu, amorțeală și furnicături) sunt mai frecvente și pot dura săptămâni sau luni. Printre constatările neurologice raportate în literatura medicală se numără paralizia facială, polineuropatia demielinizantă și plexopatia brahială. Sindromul de detresă respiratorie și un sindrom asemănător unui șoc septic sau toxic au fost raportate, dar par a fi mai puțin frecvente decât în cazul HME. Rata globală de mortalitate din HGA este foarte scăzută (mai puțin de 1%), majoritatea deceselor fiind cauzate de infecții oportuniste (de exemplu, esofagită herpetică simplex, pneumonită cu Candida și aspergiloză pulmonară) la pacienții imunocompromiși.
Diagnostic
Analizele de sânge standard în HGA dezvăluie, de obicei, rezultate similare cu cele observate în HME: leucopenie, trombocitopenie și anomalii ale funcției hepatice (transaminaze crescute). Cu toate acestea, anomaliile hematologice se rezolvă frecvent până în a doua săptămână de simptome, astfel încât absența lor trebuie interpretată în acest context dacă pacienții se prezintă mai târziu în cursul bolii. În general, tratamentul antibiotic empiric trebuie luat în considerare pentru pacienții din zonele endemice care se prezintă cu o boală febrilă acută sugestivă de HGA.
Pentru diagnosticul specific, frotiurile de sânge colorate cu Wright sau Giemsa au un randament ușor mai mare decât cu HME, dar tot nu sunt optime pentru utilitatea clinică generală, având în vedere că pare să existe o mare variație (25-75%) în ceea ce privește sensibilitatea acestor teste în vizualizarea morlei în neutrofilele gazdei. Mai utile, dar nu întotdeauna disponibile, sunt testele de reacție în lanț a polimerazei (PCR), care se estimează că au o sensibilitate de 67-90%. Antibioterapia anterioară reduce dramatic sensibilitatea acestor două metode de diagnostic.
Testul serologic este util pentru a confirma diagnosticul de anaplasmoză. Cea mai frecvent utilizată metodă este imunofluorescența indirectă (IFA) a anticorpilor IgM și IgG anti-A. phagocytophilum. Seroconversia este probabil cea mai sensibilă dovadă de laborator a infecției cu A. phagocytophilum, dar nu este întotdeauna obținută în timp util pentru a oferi o contribuție utilă la deciziile clinice (de exemplu, la tratament).
.