Chemistry for Non-Majors
Obiective de învățare
- Definiți raza atomică.
- Descrieți cum se modifică atomul în cadrul unei perioade.
- Descrieți cum se modifică raza atomică în cadrul unui grup.
Cum pot încăpea toți acești oameni într-un spațiu atât de mic?
 Evenimentele atrag la ele un număr mare de oameni. Chiar și un eveniment în aer liber se poate umple astfel încât să nu mai fie loc pentru mai mulți oameni. Capacitatea mulțimii depinde de cantitatea de spațiu din locație, iar cantitatea de spațiu depinde de mărimea obiectelor care îl umplu. Putem băga mai mulți oameni într-un spațiu dat decât elefanții, deoarece elefanții sunt mai mari decât oamenii. Putem băga mai multe veverițe în același spațiu decât oameni, din același motiv. Cunoașterea dimensiunilor obiectelor cu care avem de-a face poate fi importantă pentru a decide cât de mult spațiu este necesar.
Evenimentele atrag la ele un număr mare de oameni. Chiar și un eveniment în aer liber se poate umple astfel încât să nu mai fie loc pentru mai mulți oameni. Capacitatea mulțimii depinde de cantitatea de spațiu din locație, iar cantitatea de spațiu depinde de mărimea obiectelor care îl umplu. Putem băga mai mulți oameni într-un spațiu dat decât elefanții, deoarece elefanții sunt mai mari decât oamenii. Putem băga mai multe veverițe în același spațiu decât oameni, din același motiv. Cunoașterea dimensiunilor obiectelor cu care avem de-a face poate fi importantă pentru a decide cât de mult spațiu este necesar.
Dimensiunile atomilor sunt importante atunci când încercăm să explicăm comportamentul atomilor sau al compușilor. Unul dintre modurile în care putem exprima dimensiunea atomilor este cu ajutorul razei atomice . Aceste date ne ajută să înțelegem de ce unele molecule se potrivesc între ele și de ce alte molecule au părți care devin prea aglomerate în anumite condiții.
Dimensiunea unui atom este definită de marginea orbitalului său. Cu toate acestea, limitele orbitalului sunt neclare și, de fapt, sunt variabile în diferite condiții. Pentru a standardiza măsurarea razelor atomice, se măsoară distanța dintre nucleele a doi atomi identici legați între ei. Raza atomică este definită ca fiind jumătate din distanța dintre nucleele atomilor identici care sunt legați între ei.

Figura 1. Raza atomică (r) a unui atom poate fi definită ca jumătate din distanța (d) dintre doi nuclee într-o moleculă diatomică.
Raze atomice au fost măsurate pentru elemente. Unitățile de măsură pentru razele atomice sunt picometrii, echivalentul a 10-12 metri. Ca exemplu, distanța internucleară dintre cei doi atomi de hidrogen dintr-o moleculă de H2 este măsurată ca fiind de 74 pm. Prin urmare, raza atomică a unui atom de hidrogen este \frac{74}{2}=37\text{ pm}.
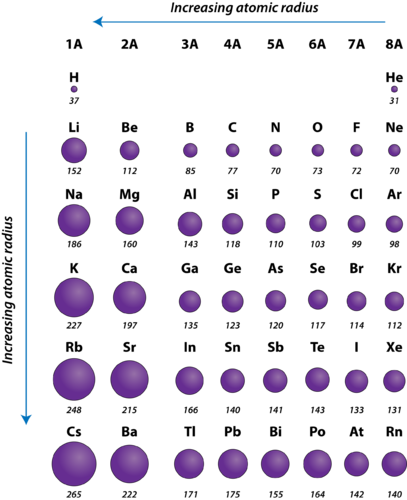
Figură 2. Raza atomică a elementelor reprezentative măsurată în picometri.
Tendința periodică
Raza atomică a atomilor scade în general de la stânga la dreapta de-a lungul unei perioade. Există câteva mici excepții, cum ar fi raza oxigenului care este ușor mai mare decât cea a azotului. În cadrul unei perioade, protonii sunt adăugați la nucleu pe măsură ce electronii sunt adăugați la același nivel energetic principal. Acești electroni sunt treptat atrași mai aproape de nucleu din cauza sarcinii pozitive crescute a acestuia. Deoarece forța de atracție dintre nuclee și electroni crește, dimensiunea atomilor scade. Efectul se diminuează pe măsură ce ne deplasăm mai la dreapta într-o perioadă, din cauza repulsiilor electron-electron care, în caz contrar, ar face ca dimensiunea atomului să crească.
Tendința grupului
Radia atomică a atomilor crește, în general, de sus în jos în cadrul unui grup. Pe măsură ce numărul atomic crește în josul unui grup, există din nou o creștere a sarcinii nucleare pozitive. Cu toate acestea, există, de asemenea, o creștere a numărului de niveluri energetice principale ocupate. Nivelurile energetice principale mai înalte constau în orbitali care au dimensiuni mai mari decât orbitalii din nivelurile energetice inferioare. Efectul numărului mai mare de niveluri principale de energie depășește creșterea sarcinii nucleare și astfel raza atomică crește în josul unui grup.

Figura 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define „atomic radius.”
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.