Cum funcționează o baterie auto și cum este construită?
Funcția tradițională a bateriei din compartimentul motor este bine cunoscută: Fără baterie, vehiculul nu poate fi pornit. Pe lângă motorul de pornire, bujiile de aprindere, bujiile incandescente, luminile și aplicațiile electronice, toate necesită energie electrică. Dar cum este construită o baterie și cum funcționează aceasta?
Baterii plumb-acid: Componente și structură
Mulți șoferi devin conștienți de greutatea mare a bateriilor auto atunci când cumpără una nouă. Sunt posibile greutăți de la aproximativ 10,5 kg, până la 30 kg. Motivul este reprezentat de plăcile de plumb din celulele bateriei.
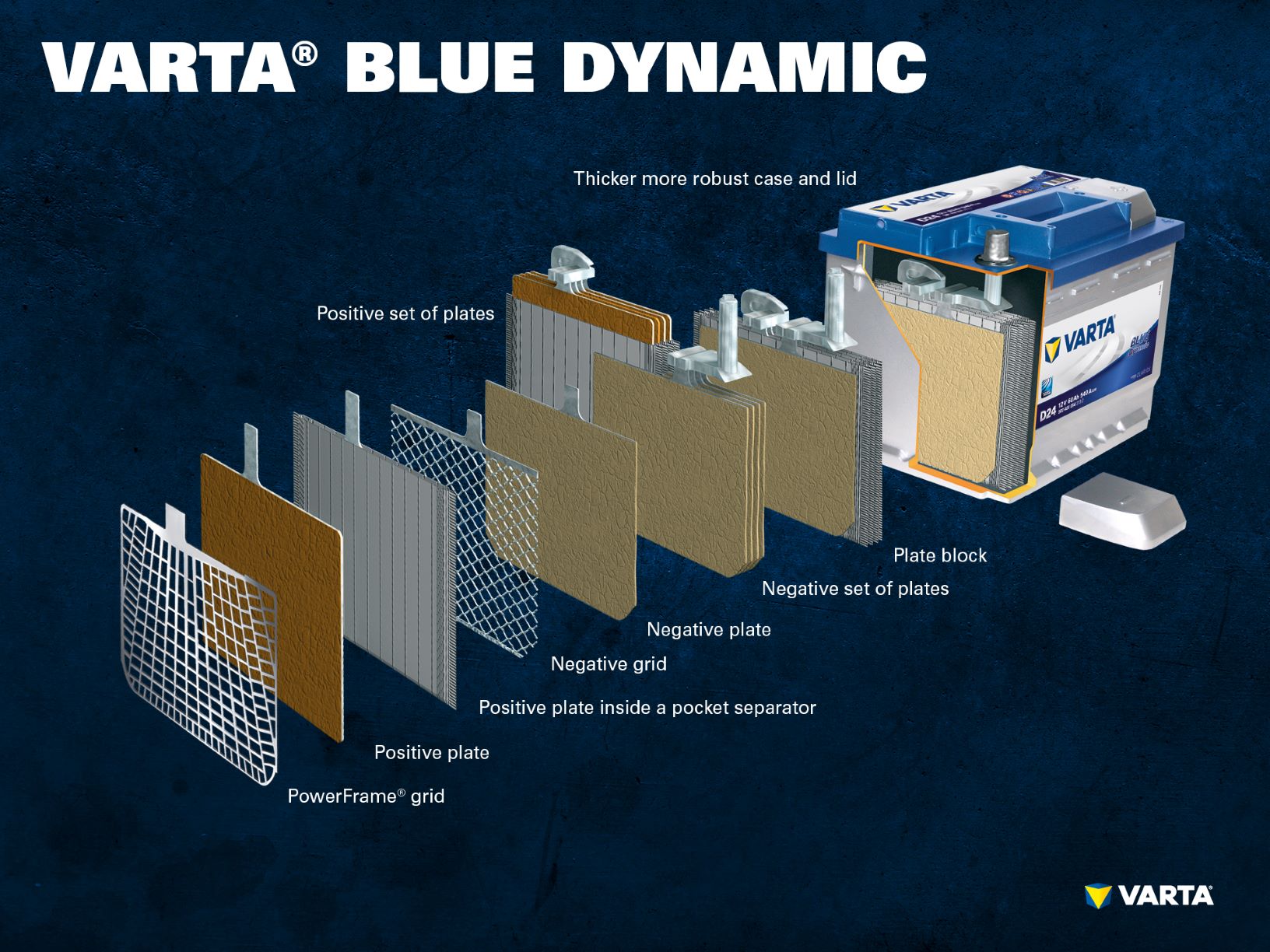
Componentele și structura unei celule de baterie
Electrodul pozitiv:
- Placă pozitivă: Într-o baterie plumb-acid, placa încărcată pozitiv (materialul activ) este formată din oxid de plumb (PbO2) care este scufundată într-un electrolit.
- Grila pozitivă: Grila pozitivă este formată dintr-un aliaj de plumb și este utilizată pentru a menține materialul activ și ca un colector de curent.
Electrod negativ:
- Placă negativă: Placa încărcată negativ (materialul activ) constă din plumb pur (Pb), care este, de asemenea, scufundată într-un electrolit.
- Placă negativă: Ca și placa pozitivă, și aceasta constă dintr-un aliaj de plumb și servește aceluiași scop.
Electrozii cu sarcini diferite sunt separați de un sac separator.
Electrolitul este un amestec de acid sulfuric (H2SO4) și apă distilată. Acest electrolit poate fi sub formă lichidă (ca în bateriile umede convenționale sau în tehnologia EFB îmbunătățită), sub formă de gel sau legat într-un covor de sticlă (ca în tehnologia AGM pentru noile aplicații start-stop).
Mai mulți electrozi pozitivi formează un set de plăci pozitive și mai mulți electrozi negativi formează un set de plăci negative. Împreună, un set de plăci negative și un set de plăci pozitive formează un bloc de plăci. Un bloc de plăci este o celulă de baterie.
O baterie de pornire convențională este formată din 6 celule conectate în serie, fiecare cu o tensiune nominală de 2 V, ceea ce duce la o tensiune de exact 12,72 V atunci când bateria este complet încărcată. Capacitatea și aptitudinea de pornire la rece a bateriei rezultă din numărul de plăci pe celulă.
Regula de bază: Cu cât mai multe plăci pe care le conține o celulă și, prin urmare, formează o suprafață mai mare, cu atât mai mare este puterea de pornire la rece (CCA) pe care o poate furniza bateria. Cu toate acestea, dacă spațiul din celulă este utilizat pentru mai puține plăci, dar mai groase, stabilitatea ciclului este mai mare. Acest lucru înseamnă că bateria este proiectată pentru un debit de încărcare mai mare (proces continuu de încărcare și descărcare).
Celele sunt conținute într-o carcasă care este fabricată din plastic rezistent la acizi (polipropilenă). În cazul unei baterii SLI convenționale, aceasta este închisă cu un capac cu un sistem labirint care împiedică scurgerea lichidului din baterie și separă lichidul de gaz.
Principalele baterii aveau dopuri cu șurub care permiteau completarea cu apă distilată. Bateriile moderne sunt complet lipsite de întreținere. Apa nu are nevoie și nu trebuie să fie și nu trebuie să fie completată. Deși bateriile AGM încă mai au „prize cu sens unic”, acestea nu trebuie deschise sub nicio formă.
Funcția bateriei auto: Energia chimică devine energie electrică
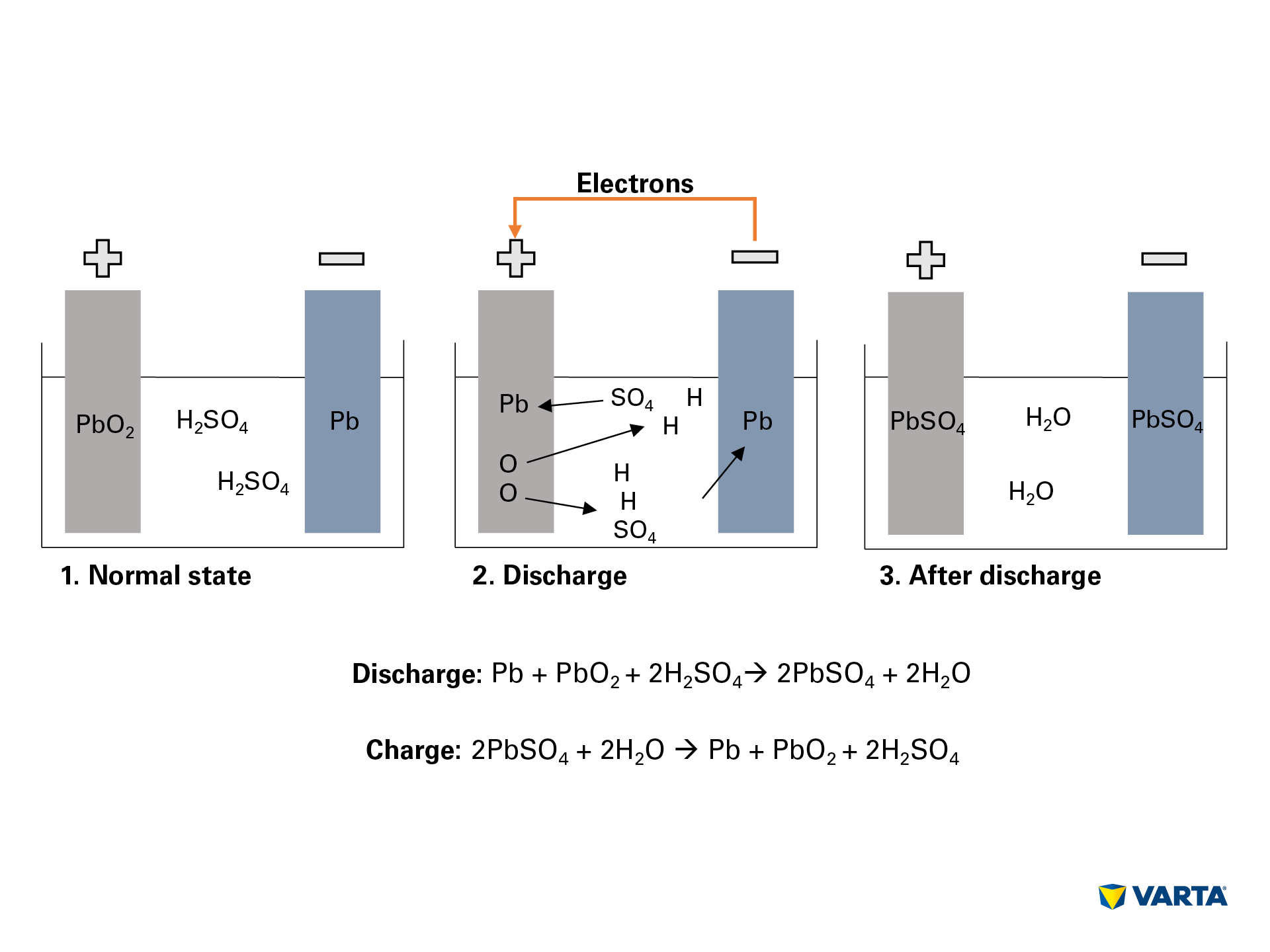
O baterie auto stochează energia sub formă chimică și o transformă în energie electrică. În acest proces electro-chimic, patru materiale reacționează între ele:
- Hidrogen (H)
- Oxid (O2)
- Plumb (Pb)
- Sulf (S)
Conectarea unui consumator extern pornește reacția chimică din baterie:
- Electrolitul, un amestec de acid sulfuric (H2SO4) și apă distilată, se descompune în ioni de hidrogen încărcați pozitiv (H+) și ioni de sulfat încărcați negativ (SO42-).
- În același timp, electronii (2e-) călătoresc de la electrodul negativ la cel pozitiv prin intermediul consumatorului extern.
- Pentru a compensa acest flux de electroni, ionii de sulfat călătoresc din electrolit în electrodul negativ, unde reacționează cu plumbul (Pb) pentru a produce sulfat de plumb (PbSO4).
- Sulfatul de plumb este, de asemenea, produs în electrodul pozitiv: Legătura oxigenului (O2) în oxidul de plumb (PbO2) este ruptă prin transferul de electroni, iar oxigenul trece în electrolit. Plumbul rămas (Pb) se leagă de sulfatul (SO4) din electrolit.
- Acolo, oxigenul se leagă de hidrogen pentru a forma apă (H2O). Pe măsură ce acidul sulfuric este consumat prin formarea sulfatului de plumb, concentrația soluției de electrolit se reduce. Atunci când concentrația acidului sulfuric scade sub un anumit nivel, bateria trebuie reîncărcată.
- În timpul încărcării, procesele chimice au loc în succesiune inversă. La final, se pot regăsi elementele originale: Electrodul pozitiv este format din sulfat de plumb (PbSO4), electrodul negativ este format din plumb pur (Pb), iar electrolitul este format din acid sulfuric diluat (H2SO4). Deoarece acest proces de conversie este asociat cu pierderi, o baterie poate rezista doar la un număr limitat de cicluri de încărcare. Prin urmare, durata sa de viață utilă este limitată.
Probleme cu bateriile plumb-acid: Sulfatarea și stratificarea acidului
Dacă o baterie este încărcată cu o tensiune prea mică sau dacă funcționează întotdeauna cu o tensiune prea mică (sub 80%), apare stratificarea acidului, denumită și stratificare. Acidul din electrolit se stratifică din cauza unui amestec slab. Diferitele densități determină stratificarea acidului sulfuric în partea de jos și a apei în zona superioară a bateriei. Din această cauză, doar secțiunea de mijloc a electrolitului, adică doar o treime, poate fi utilizată pentru procesul de descărcare și încărcare.
O posibilă cauză a stratificării acidului este reprezentată în principal de călătoriile scurte cu utilizarea simultană a unui număr mare de consumatori electrici. În acest caz, alternatorul nu are timp suficient pentru a reîncărca bateria. 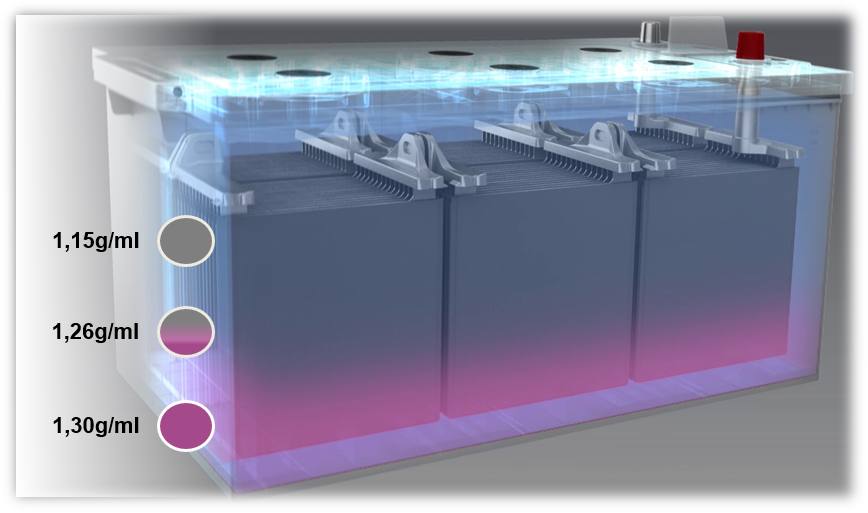
Un rezultat al stratificării acidului este sulfatarea. Dacă aceasta apare în baterie sau dacă aceasta nu este încărcată în mod constant la un nivel adecvat, sulfatul de plumb (PbSO4) se cristalizează pe electrozi, pentru a forma structuri cristaline mai mari de-a lungul timpului. Acest proces este cunoscut sub numele de „sulfatare”. Cristalizarea împiedică reconversia sulfatului de plumb în componentele originale plumb sau oxid de plumb, ceea ce duce la împiedicarea acceptării încărcăturii și la reducerea puterii de pornire la rece.
Cristalele ascuțite pot, de asemenea, să deterioreze separatoarele sau să provoace scurtcircuite în celule.
Pentru a contracara acest efect și a preveni defectarea prematură a bateriei, o baterie nu trebuie niciodată supusă unui nivel de încărcare scăzut pe o perioadă lungă de timp. Pentru aceasta, se recomandă testarea regulată a bateriei și încărcarea completă a acesteia, dacă este necesar.
Doriți să aflați mai multe despre acest subiect? Cum se încarcă corect o baterie.
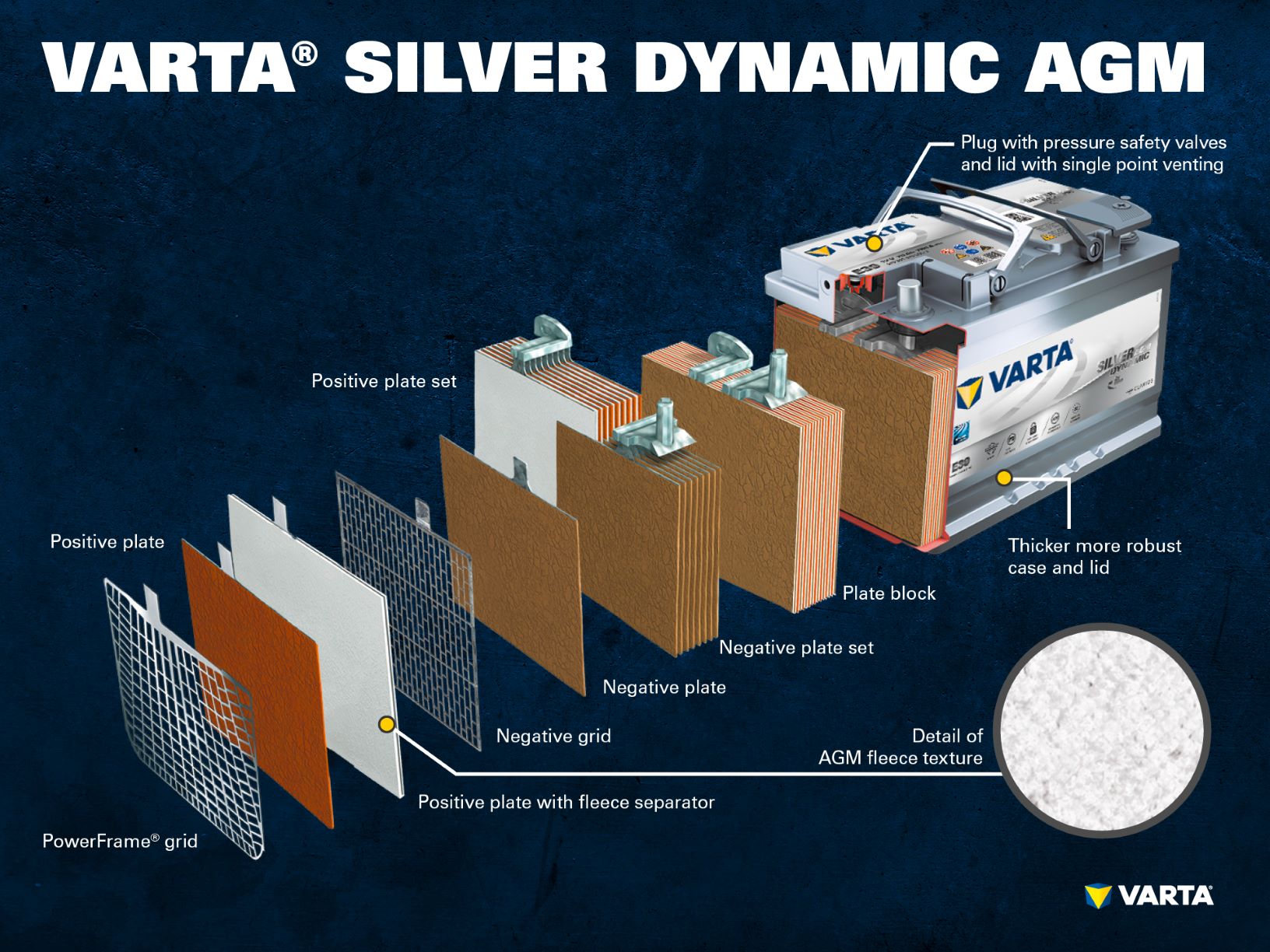
Noi tehnologii pentru baterii: AGM și litiu-ion
Până în prezent, bateriile convenționale cu plumb-acid au avut o cotă mare de piață. Cu toate acestea, piața se schimbă rapid: Tehnologiile inovatoare de baterii pentru vehiculele start-stop, cum ar fi AGM, utilizează acid care este legat într-un covor pentru a oferi o stabilitate mai mare a ciclului și pentru a garanta o performanță fiabilă în vehiculele cu cerințe energetice sporite. Un alt avantaj al AGM: stratificarea acidului nu mai este posibilă din cauza acidului legat.
O nouă generație de baterii auto pentru vehicule microhibride funcționează la 48V și utilizează celule cu tehnologie litiu-ion.
.