Familia oxigenului
Familia oxigenului este formată din elementele care alcătuiesc grupa 16 din tabelul periodic: oxigenul, sulful, seleniul, telurul și poloniul. Aceste elemente au toate șase electroni în nivelul energetic cel mai exterior, ceea ce explică unele proprietăți chimice comune între ele. Într-o altă privință, elementele sunt foarte diferite unele de altele. Oxigenul este un nemetal gazos; sulful și seleniul sunt nemetale solide; telurul este un metaloid solid; iar poloniul este un metal solid.
Cuvinte de știut
Acid: Substanțe care, atunci când sunt dizolvate în apă, sunt capabile să reacționeze cu o bază pentru a forma săruri și a elibera ioni de hidrogen.
Alotrop: Una dintre cele două sau mai multe forme ale unui element.
Combustie: O formă de oxidare care are loc atât de rapid încât se produce căldură și lumină notabile.
Cracare: Procesul prin care moleculele mari de hidrocarburi sunt descompuse în componente mai mici.
Electroliză: Procesul prin care un curent electric provoacă o schimbare chimică, de obicei descompunerea unei substanțe.
Izotopi: Două sau mai multe forme ale aceluiași element cu același număr de protoni, dar cu numere diferite de neutroni în nucleul atomic.
Litosferă: Partea solidă a Pământului, în special regiunea exterioară a scoarței terestre.
LOX: O abreviere pentru oxigen lichid.
Metalurgie: Știința și tehnologia care se ocupă cu obținerea metalelor din minereurile lor și transformarea lor în forme care au valoare practică.
Oxigen nazal: Un alotrop de oxigen ale cărui molecule conțin fiecare un singur atom de oxigen.
Ozon: Un alotrop de oxigen care constă din trei atomi pe moleculă.
Gaz de producție: Un combustibil sintetic care constă în principal din gazele monoxid de carbon și hidrogen.
Proteine: Molecule mari care sunt esențiale pentru structura și funcționarea tuturor celulelor vii.
Dezintegrare radioactivă: Modul previzibil în care o populație de atomi ai unui element radioactiv se dezintegrează în mod spontan în timp.
Oxigen
Oxigenul este un gaz incolor, inodor și insipid, cu un punct de topire de -218°C (-360°F) și un punct de fierbere de -183°C (-297°F). Este cel mai abundent element din scoarța terestră, constituind aproximativ un sfert din atmosfera în greutate, aproximativ jumătate din litosferă (scoarța terestră) și aproximativ 85% din hidrosferă (oceane, lacuri și alte forme de apă). Se găsește atât ca element liber, cât și într-o mare varietate de compuși. În atmosferă, există sub formă de oxigen elementar, cunoscut uneori sub numele de dioxigen, deoarece este format din molecule diatomice, O 2 . În apă se găsește sub formă de oxid de hidrogen, H 2 O, iar în litosferă apare în compuși precum oxizi, carbonați, sulfați, silicați, fosfați și nitrați.
Oxigenul există, de asemenea, în două forme alotropice (forme diferite din punct de vedere fizic sau chimic ale aceleiași substanțe): un atom pe moleculă (O) și trei atomi pe moleculă (O 3 ). Primul alotrop este cunoscut sub numele de oxigen monatomic, sau nascent, iar cel de-al doilea sub numele de oxigen triatomic, sau ozon. În majoritatea circumstanțelor din natură, predomină forma diatomică a oxigenului. Cu toate acestea, în partea superioară a stratosferei, energia solară determină descompunerea formei diatomice în forma monatomică, care se poate apoi recombina cu moleculele diatomice pentru a forma ozon. Prezența ozonului în atmosfera terestră este esențială pentru supraviețuirea vieții pe Pământ, deoarece acest alotrop are tendința de a absorbi radiațiile ultraviolete care, altfel, ar fi dăunătoare sau chiar fatale atât pentru viața vegetală, cât și pentru cea animală de la suprafața planetei.
Oxigenul a fost descoperit independent de chimistul suedez Carl Scheele (1742-1786) și de chimistul englez Joseph Priestley (1733-1804) în perioada cuprinsă între 1773 și 1774. Elementul a primit numele său la sfârșitul anilor 1770 de către chimistul francez Antoine Laurent Lavoisier (1743-1794). Numele său provine de la cuvântul francez pentru „formator de acid”, reflectând convingerea incorectă a lui Lavoisier că toți acizii conțin oxigen.
Producție. De departe, cea mai comună metodă de producere a oxigenului în scop comercial este prin distilarea fracționată a aerului lichid. O mostră de aer este mai întâi răcită la o temperatură foarte scăzută, în intervalul de -200°C (-330°F). La această temperatură, majoritatea gazelor care compun aerul devin lichide. Aerul lichid este apoi lăsat să se evapore. La o temperatură de aproximativ -196°C (-320°F), azotul începe să se desprindă prin fierbere. Când cea mai mare parte a azotului a dispărut, argonul și neonul se evaporă și ele, lăsând în urmă o formă impură de oxigen. Oxigenul este impur deoarece în forma lichidă pot rămâne cantități mici de kripton, xenon și alte gaze. Pentru a purifica și mai mult oxigenul, procesul de răcire, lichefiere și evaporare poate fi repetat.
În mod obișnuit, oxigenul este stocat și transportat în forma sa lichidă, formă cunoscută și sub numele de LOX (de la l iquid ox ygen). Containerele LOX arată ca niște sticle de vid foarte mari, care constau dintr-un recipient cu pereți dubli, cu un vid între pereți. Elementul poate fi, de asemenea, depozitat și transportat mai puțin ușor sub formă gazoasă în containere cu pereți de oțel cu o înălțime de aproximativ 1,2 metri (4 picioare) și un diametru de 23 de centimetri (9 inci). În multe cazuri, oxigenul este fabricat la locul unde va fi utilizat. Procedeul de distilare fracționată descris anterior este suficient de simplu și ieftin pentru ca multe industrii să își poată asigura propriile instalații de producere a oxigenului.
Utilizări. Oxigenul are atât de multe utilizări comerciale, industriale și de altă natură încât se situează în mod constant printre primele cinci substanțe chimice în ceea ce privește volumul de producție în Statele Unite. În 1990, de exemplu, în Statele Unite au fost fabricate aproximativ 18 miliarde de kilograme (39 miliarde de lire sterline) din acest element.
Utilizările la care este supus oxigenul pot fi clasificate în patru categorii majore: metalurgie, rachetă, sinteză chimică și medicină. În procesul de prelucrare a minereului de fier într-un furnal, de exemplu, oxigenul este utilizat pentru a transforma cocsul (carbonul) în monoxid de carbon. Monoxidul de carbon, la rândul său, reduce oxizii de fier în fier metalic pur. Oxigenul este apoi utilizat într-o a doua etapă a prelucrării fierului în convertorul Bessemer, în cuptorul deschis sau în metoda de bază cu oxigen pentru transformarea „fontei” în oțel. În această etapă, oxigenul este utilizat pentru a reacționa cu excesul de carbon, siliciu și metale rămase în fonta brută, care trebuie eliminate pentru a produce oțel.
O altă aplicație metalurgică a oxigenului este în torțele utilizate pentru sudare și tăiere. Cele două torțe cele mai comune utilizează reacția dintre oxigen și hidrogen (torța oxihidrogen) sau dintre oxigen și acetilenă (torța oxiacetilenică). Ambele tipuri de torțe produc temperaturi în intervalul de 3.000°C (5.400°F) sau mai mult și, prin urmare, pot fi utilizate pentru a tăia sau a suda marea majoritate a materialelor metalice.
Sub formă de LOX, oxigenul este utilizat pe scară largă ca agent oxidant în multe tipuri de rachete și rachete. De exemplu, imensul rezervor extern de combustibil necesar pentru a ridica naveta spațială în spațiu conține 550.000 de litri (145.000 de galoane) de oxigen lichid și 1.500.000 de litri (390.000 de galoane) de hidrogen lichid. Atunci când aceste două elemente reacționează în motoarele principale ale navetei, ele asigură o împingere maximă de 512.000 de lire sterline.
Industria chimică utilizează cantități uriașe de oxigen în fiecare an într-o varietate de reacții de sinteză (formare) chimică. Una dintre cele mai importante dintre acestea este cracarea hidrocarburilor de către oxigen. În cele mai multe circumstanțe, încălzirea unei hidrocarburi cu oxigen duce la combustie, cu dioxid de carbon și apă ca produse principale. Cu toate acestea, dacă rata la care oxigenul este introdus într-un amestec de hidrocarburi este controlată cu atenție, hidrocarbura este „crăpată” sau descompusă pentru a produce alți produse, cum ar fi acetilena, etilena și propilena.
Diferite tipuri de combustibili sintetici pot fi, de asemenea, fabricate cu oxigenul ca unul dintre principalii reactanți. Gazul de producție, ca exemplu, este fabricat prin trecerea oxigenului la o rată controlată printr-un pat de cărbune sau cocs fierbinte. Cea mai mare parte a dioxidului de carbon produs în această reacție este redusă la monoxid de carbon, astfel încât produsul final (gazul de producător) constă în principal din monoxid de carbon și hidrogen.
Poate cea mai cunoscută aplicație medicală a oxigenului este în oxigenoterapie, unde pacienților care au probleme de respirație li se administrează doze de oxigen pur sau aproape pur. Oxigenoterapia este adesea utilizată în timpul procedurilor chirurgicale, în timpul nașterii, în timpul recuperării după un atac de cord și în timpul tratamentului pentru boli infecțioase. În fiecare caz, furnizarea de oxigen pur unei persoane reduce stresul asupra inimii și plămânilor acesteia, accelerând rata de recuperare.
Oxigenul pur sau aerul îmbogățit cu oxigen poate fi furnizat, de asemenea, în medii în care respirația poate fi dificilă. Avioanele care zboară la altitudini mari, bineînțeles, sunt întotdeauna prevăzute cu rezerve de oxigen în cazul în care apar probleme cu alimentarea normală cu aer a navei. De asemenea, scafandrii de mare adâncime au asupra lor sau li se pompează rezerve de aer îmbogățit cu oxigen.
Unele instalații de purificare a apei și de tratare a apelor uzate folosesc oxigen. Gazul este pompat prin apă pentru a crește rata la care bacteriile care apar în mod natural descompun materialele reziduale organice. S-a constatat că un proces similar reduce rata la care are loc eutrofizarea lacurilor și iazurilor și, în unele cazuri, chiar inversează acest proces. (Eutrofizarea este dizolvarea nutrienților într-un corp de apă. Creșterea numărului de plante acvatice și scăderea oxigenului dizolvat sunt cele două rezultate principale ale procesului).
În cele din urmă, oxigenul este esențial pentru toată viața animală de pe Pământ. O persoană poate supraviețui câteva zile sau săptămâni fără apă sau hrană, dar nu mai mult de câteva minute fără oxigen. În absența oxigenului, reacțiile chimice generatoare de energie care au loc în interiorul celulelor s-ar încheia, iar o persoană ar muri.
Sulf
Sulful este un element nemetalic care poate exista în multe forme alotropice (forme fizice sau chimice diferite din punct de vedere fizic sau chimic ale aceleiași substanțe). Cele mai cunoscute se numesc sulf rombic și monoclinic. Ambele sunt solide de culoare galben strălucitor, cu puncte de topire de aproximativ 115°C (239°F). O a treia formă se numește sulf plastic sau amorf. Este un lichid maroniu produs la topirea sulfului rombic sau monoclinic.
Sulful în sine nu are nici un miros. Cu toate acestea, are o reputație proastă în această privință, deoarece unii dintre cei mai comuni compuși ai săi au mirosuri puternice. Dioxidul de sulf, unul dintre acești compuși, are un efect ascuțit, sufocant, sufocant pentru oricine îl respiră. „Focul și pucioasa” din Biblie a fost una dintre cele mai rele pedepse pe care și le puteau imagina autorii ei. Piatra de foc din această expresie se referea la sulf arzând, sau la dioxidul de sulf. Faptul că sulful provine din adâncurile pământului și că dioxidul de sulf poate fi mirosit în fumul vulcanilor a alimentat și mai mult imaginația oamenilor despre cum trebuie să fie Iadul.
Un al doilea compus al sulfului cu un miros neplăcut este hidrogenul sulfurat. Mirosul puternic de ouă stricate se datorează prezenței acestui compus.
Apariție și preparare. Sulful este al șaisprezecelea cel mai abundent element din scoarța terestră. Apare atât ca element, cât și într-o varietate de compuși. Ca element, poate fi găsit în mine subterane foarte mari, cel mai frecvent de-a lungul coastei Golfului din Statele Unite și în Polonia și Sicilia. Sulful este extras din aceste mine prin intermediul procedeului Frasch. În cadrul acestui proces, aburul supraîncălzit este pompat prin cea mai exterioară dintr-un set de trei țevi. Aerul comprimat este forțat să coboare prin conducta cea mai interioară. Aburul supraîncălzit face ca sulful din subteran să se topească, iar aerul comprimat îl împinge în sus, prin mijlocul celor trei țevi, până la suprafața Pământului.
Sulful este, de asemenea, larg răspândit sub formă de minerale și minereuri. Multe dintre acestea sunt sub formă de sulfați, inclusiv gipsul (sulfat de calciu, CaSO 4 ), baritul (sulfat de bariu, BaSO 4 ) și sărurile Epsom (sulfat de magneziu, MgSO 4 ). Altele sunt sulfuri metalice, inclusiv pirită de fier (sulfură de fier, FeS 2 ), galenă (sulfură de plumb, PbS), cinabru (sulfură mercurică, HgS), stibită (sulfură de antimoniu, Sb 2 S 3 ) și blenda de zinc (sulfură de zinc, ZnS). Sulful este recuperat din aceste minereuri metalice prin încălzirea puternică a acestora în aer, ceea ce transformă sulful în dioxid de sulf și eliberează metalul pur. Apoi, dioxidul de sulf poate intra direct în procesul de fabricare a acidului sulfuric, unde ajunge mai mult de 90 la sută din sulful extras din minele mondiale.
Utilizări ale sulfului și ale compușilor săi. O parte din sulf este folosită direct ca fungicid și insecticid, în chibrituri, artificii și praf de pușcă, precum și în vulcanizarea cauciucului natural (un tratament care conferă cauciucului elasticitate și rezistență). Cea mai mare parte, însă, este transformată într-o multitudine de compuși utili.
Acidul sulfuric este, de departe, cel mai important dintre toți compușii sulfului. Aproape 90 la sută din tot sulful produs este transformat mai întâi în dioxid de sulf și apoi în acid sulfuric. Acidul se situează în mod constant pe primul loc în topul produselor chimice produse în Statele Unite. În 1990, au fost fabricate peste 40 de miliarde de kilograme (89 de miliarde de lire sterline) de acid sulfuric, mai mult de 50 la sută mai mult decât a doua cea mai populară substanță chimică (azot gazos). Acidul sulfuric este utilizat în producția de îngrășăminte, baterii de automobile, produse petroliere, pigmenți, fier și oțel și multe alte produse.
Ciclul sulfului. Ca și azotul, carbonul și fosforul, sulful trece prin părțile gazoase, lichide și solide ale planetei noastre într-o serie de reacții continue cunoscute sub numele de ciclul sulfului. Principalele etape ale ciclului sulfului sunt ilustrate în figura alăturată.
Sulful este produs în mod natural ca urmare a erupțiilor vulcanice și prin emisii de la izvoarele fierbinți. El intră în atmosferă în principal sub formă de dioxid de sulf, apoi rămâne în atmosferă sub această formă sau, după ce reacționează cu apa, sub formă de acid sulfuric. Sulful este transportat înapoi la suprafața Pământului sub formă de depunere acidă atunci când plouă sau ninge.
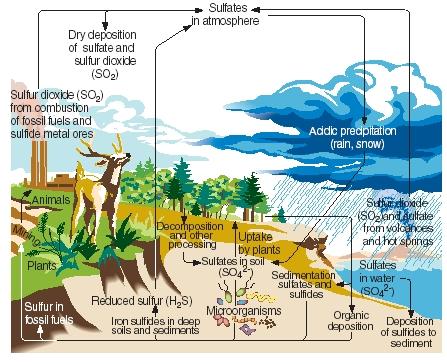
.)
La suprafața Pământului, dioxidul de sulf și acidul sulfuric reacționează cu metalele pentru a forma sulfați și sulfuri. Elementul este, de asemenea, încorporat de plante într-o formă cunoscută sub numele de sulf organic. Anumiți aminoacizi, compușii din care sunt fabricate proteinele, conțin sulf. Sulful organic din plante trece în cele din urmă la animalele care mănâncă aceste plante. Acesta este, la rândul său, transformat din proteine vegetale în proteine animale.
Când plantele și animalele mor, sulful se întoarce în sol, unde este transformat de microorganisme în hidrogen sulfurat. Hidrogenul sulfurat gazos este apoi returnat în atmosferă, unde este oxidat în acid sulfuric.
Activitățile umane influențează ciclul sulfului în mai multe moduri. De exemplu, atunci când cărbunele și minereurile metalice sunt exploatate, sulful și sulfurile pot fi eliberate și returnate în sol. De asemenea, arderea cărbunelui, a petrolului și a gazelor naturale eliberează adesea dioxid de sulf în atmosferă. Acest dioxid de sulf se adaugă la cantitatea deja prezentă din surse naturale, crescând considerabil cantitatea de precipitații acide care cad la suprafața Pământului. Unii oameni cred că precipitațiile acide (sau ploaia acidă) sunt responsabile de moartea copacilor și a altor plante, de acidificarea lacurilor care a afectat animalele marine, de deteriorarea structurilor din metal și piatră și de alte daune aduse mediului.
Seleniu, telur și poloniu
Seleniul și telurul sunt ambele elemente relativ rare. Ele se situează în ultimele zece procente dintre toate elementele din punct de vedere al abundenței. Ele tind să apară în scoarța terestră în asociere cu minereuri de cupru și alte metale. Ambele sunt obținute ca produs secundar al rafinării electrolitice a cuprului. În timpul acestui proces, ele se scufundă pe fundul bazinului de electroliză, de unde pot fi îndepărtate din nămolul care se formează.
Seleniul apare într-o varietate de forme alotropice (forme diferite din punct de vedere fizic sau chimic ale aceleiași substanțe), dintre care cea mai comună este o pulbere roșie care devine neagră atunci când este expusă la aer. Punctul de topire al elementului este de 217°C (423°F), iar punctul său de fierbere este de 685°C (1.265°F). Telurul este un solid alb-argintiu care arată ca un metal (deși este de fapt un metaloid). Punctul său de topire este de 450°C (842°F), iar punctul său de fierbere este de 990°C (1.814°F).
Seleniul are un rol interesant în organismele vii. Este esențial în concentrații foarte mici pentru menținerea sănătății la majoritatea animalelor. De fapt, este adesea adăugat în hrana animalelor. Cu toate acestea, în concentrații mai mari, s-a constatat că elementul are efecte nocive asupra animalelor, provocând deformarea puilor și adulți bolnavi.
Principalele utilizări ale seleniului sunt în electronică și în fabricarea sticlei colorate. Mașinile de fotocopiere, celulele solare, celulele fotoelectrice, tuburile de imagine ale televizoarelor, precum și redresoarele și releele electronice (folosite pentru a controla fluxul de curent electric) utilizează seleniu. Unele dintre cele mai frumoase ochelari colorați, variind de la roz pal la roșu strălucitor, sunt fabricate cu compuși de seleniu.
Cantități mici de telur sunt, de asemenea, utilizate în producția de sticlă colorată. Cu toate acestea, mai mult de 90 la sută din acest element merge la producția de aliaje de fier și alte metale.
Poloniul are 27 de izotopi, toți fiind radioactivi. Apare în mod natural în minereurile de uraniu, unde este produsul final în lunga serie de reacții prin care uraniul suferă dezintegrare radioactivă. Este unul dintre cele mai rare elemente de pe Pământ, cu o abundență nu mai mare de aproximativ 3 × 10 -10 părți pe milion. Descoperirea poloniului în 1898 de către chimista franco-poloneză Marie Curie (1867-1934) este una dintre cele mai dramatice povești din istoria științei. Ea a prelucrat tone de minereu de uraniu pentru a obține câteva miligrame din noul element, pe care l-a numit apoi după Polonia, țara sa natală. Poloniul își găsește o utilizare limitată în dispozitive generatoare de energie foarte specializate, cum ar fi cele utilizate pentru sateliții spațiali și sondele spațiale.