H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
Structura Lewis a H2S
Structura Lewis a oricărui compus este o reprezentare structurală a electronilor de valență care participă la formarea legăturii împreună cu perechile de electroni nelegate. Cunoașterea structurii Lewis a unui anumit compus chimic este esențială, deoarece oferă informațiile necesare despre toate celelalte proprietăți chimice ale compusului respectiv.
Reprezentarea este afișată cu ajutorul punctelor și liniilor care reprezintă electronii. Punctele reprezintă electronii care nu participă la formarea legăturii. În timp ce liniile reprezintă legăturile din compus. Structura este realizată pe baza regulii octetului. Regula Octetului din chimie afirmă că ar trebui să existe opt electroni în învelișul exterior al unui element pentru ca acesta să fie stabil.
Structura Lewis a sulfurii de hidrogen este ușor de desenat și de înțeles. În acest compus, ambii atomi de hidrogen au nevoie de un electron pentru a realiza legătura covalentă cu Sulful. Structura Lewis a H2S este similară cu cea a H2S. Sulful are nevoie de opt electroni pentru a îndeplini cerințele regulii Octetului. Dar hidrogenul are nevoie doar de un singur electron pentru a deveni stabil, deoarece aparține elementelor din grupa 1.
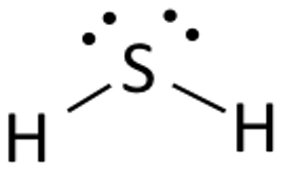
Puneți atomul de sulf în mijloc și aranjați electronii de valență în jurul acestuia.
Acum plasați doi atomi de Hidrogen de o parte și de alta a atomului central.
Aici electronii de valență ai Sulfului sunt folosiți pentru a face Hidrogenul stabil prin donarea unui electron către ambii atomi de Hidrogen. Doi din cei șase electroni de valență participă la formarea legăturii.
Desenați linii ( pentru a arăta legăturile) între atomii de Hidrogen și de Sulf.
Cei patru electroni rămași sunt electroni de nelegătură și, prin urmare, sunt afișați sub formă de puncte în apropierea atomului de Sulfură. În total există două perechi de electroni nelegători în acest compus, iar atomii de hidrogen au un înveliș de valență complet.
Hibridizarea H2S
Pentru a înțelege hibridizarea H2S, este vital să cunoaștem mai întâi două lucruri:
- Numărul de legături din compus și tipul acestora
Este esențial să cunoaștem tipul de legătură din compus pentru a cunoaște hibridizarea acestuia. În molecula H2S, doi atomi de hidrogen formează o legătură cu atomul central de sulf. În moleculă se formează două legături simple. Aceste legături ocupă patru electroni de valență și, prin urmare, rămân alți patru electroni de valență. În timpul formării unei legături, orbitalul s al atomului de hidrogen se suprapune cu orbitalul p al atomului de sulf. Perechea solitară de electroni ocupă doi dintre orbitalii sp3. Ceilalți doi orbitali sp3 se suprapun cu orbitalul 1s al atomului de hidrogen.
Acest aranjament duce la hibridizarea sp3 a moleculei H2S. Suprapunerea celor doi orbitali hibrizi formează două legături sigma între atomul de Hidrogen și cel de Sulf.
- Numărul steric al compusului dat
Numărul steric este definit ca fiind regiunea de densitate electronică observată în jurul atomului central. În acest caz, deoarece Sulful este atomul central, numărul steric al compusului va fi totalul cumulat al atomilor legați de atomul central și numărul de perechi de electroni solitari din jurul atomului central.
Formula pentru aflarea acestui număr este:
Numărul steric (SN)
= Nr. de legături sigma pe atomul central +Nr. de perechi de electroni solitari pi pe atomul central
În acest caz al moleculelor de H2S, există două legături sigma și există două perechi de electroni solitari pe atomul central.

Atunci SN al moleculei H2S = 2+2
=4
Ca urmare a faptului că numărul steric al H2S este patru, acesta are doi
orbitali hibrizi și două perechi singuratice de electroni care îl fac să fie o hibridizare sp3.
Acum că știm structura Lewis și hibridizarea moleculei, este ușor de determinat geometria moleculară a acesteia.
H2S Geometrie moleculară
Hibridizarea moleculei date H2S este sp3; atomul de sulf se află în centrul legăturii cu doi atomi de hidrogen formând unghiul de legătură mai mic de 180 de grade. Conform teoriei VSEPR, perechile singuratice de electroni se resping reciproc, dar cum atomul de sulf este mai puțin electronegativ, unghiul de legătură scade la 104,5 grade.
Această scădere a unghiului duce la o structură curbată.
O altă modalitate de a cunoaște geometria moleculară este prin metoda AXN. Unde A reprezintă atomul central, X reprezintă numărul de perechi de electroni legați și N reprezintă perechea de electroni solitari. Aici, formula generală va fi AX2N2 datorită celor două perechi de electroni de legătură și două perechi de electroni solitari. Astfel, această moleculă prezintă o geometrie curbată.
Polaritatea H2S
Acum că avem informațiile necesare despre moleculă, este ușor de determinat polaritatea acesteia. Polaritatea oricărei molecule date depinde de geometria sa moleculară și de electronegativitatea generală. Deoarece atomul de sulf este mai puțin electronegativ, electronegativitatea globală a compusului este mai mică de 0,4, ceea ce îl face nepolar.
Așa se poate spune că molecula H2S este nepolară.
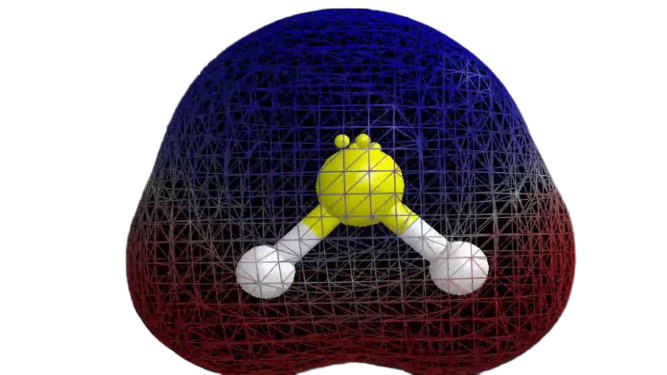
Observații finale
Din informațiile de mai sus, se poate concluziona că molecula H2S are opt electroni de valență, hibridizare sp3, geometrie moleculară curbată și este nepolară.