Ideile timpurii despre materie: De la Democritus la Dalton
Teorie atomică modernă

Priestley, Lavoisier și alții au pus bazele domeniului chimiei. Experimentele lor au arătat că unele substanțe se puteau combina cu altele pentru a forma noi materiale, alte substanțe puteau fi descompuse pentru a forma altele mai simple, iar câteva „elemente” cheie nu mai puteau fi descompuse. Dar ce ar putea explica acest set complex de observații? John Dalton, un profesor și om de știință britanic de excepție, a pus cap la cap piesele și a elaborat prima teorie atomică modernă în 1803. Pentru a afla mai multe despre experimentele lui Priestley și Lavoisier și despre modul în care acestea au stat la baza teoriilor lui Dalton, încercați experimentul interactiv Dalton’s Playhouse, cu linkul de mai jos.
Dalton și-a făcut un obicei regulat din urmărirea și înregistrarea vremii în orașul său natal, Manchester, Anglia. Prin observațiile sale asupra ceții de dimineață și a altor modele meteorologice, Dalton și-a dat seama că apa ar putea exista ca un gaz care se amestecă cu aerul și ocupă același spațiu ca și aerul. Solidele nu puteau ocupa același spațiu unul cu celălalt; de exemplu, gheața nu se putea amesteca cu aerul. Așadar, ce ar putea permite apei să se comporte uneori ca un solid și alteori ca un gaz? Dalton și-a dat seama că toată materia trebuie să fie compusă din particule mici. În stare gazoasă, aceste particule pluteau liber și se puteau amesteca cu alte gaze, așa cum propusese Bernoulli. Dar Dalton a extins această idee pentru a o aplica la toată materia – gaze, solide și lichide. Dalton a propus pentru prima dată o parte a teoriei sale atomice în 1803, iar mai târziu a rafinat aceste concepte în lucrarea sa clasică din 1808, A New System of Chemical Philosophy (pe care o puteți accesa prin intermediul unui link din fila Resurse).
Teoria lui Dalton avea patru concepte principale:
-
Toată materia este compusă din particule indivizibile numite atomi. Bernoulli, Dalton și alții și-au imaginat atomii ca fiind mici particule asemănătoare unor bile de biliard în diferite stări de mișcare. Deși acest concept este util pentru a ne ajuta să înțelegem atomii, el nu este corect, după cum vom vedea în modulele ulterioare privind teoria atomică, la care se face legătura în partea de jos a acestui modul.
-
Toți atomii unui anumit element sunt identici; atomii unor elemente diferite au proprietăți diferite. Teoria lui Dalton a sugerat că fiecare atom al unui element, cum ar fi oxigenul, este identic cu orice alt atom de oxigen; în plus, atomii unor elemente diferite, cum ar fi oxigenul și mercurul, sunt diferiți unul de celălalt. Dalton a caracterizat elementele în funcție de greutatea lor atomică; cu toate acestea, atunci când au fost descoperiți izotopi ai elementelor la sfârșitul anilor 1800, acest concept s-a schimbat.
-
Reacțiile chimice implică combinarea atomilor, nu distrugerea atomilor. Atomii sunt indestructibili și neschimbabili, astfel încât compușii, cum ar fi apa și calul de mercur, se formează atunci când un atom se combină chimic cu alți atomi. Acesta a fost un concept extrem de avansat pentru epoca sa; în timp ce teoria lui Dalton presupunea că atomii se leagă între ei, vor trece mai bine de 100 de ani până când oamenii de știință vor începe să explice conceptul de legătură chimică.
-
Când elementele reacționează pentru a forma compuși, ele reacționează în proporții definite, de numere întregi. Experimentele pe care Dalton și alții le-au efectuat au arătat că reacțiile nu sunt evenimente aleatorii; ele se desfășoară în conformitate cu formule precise și bine definite. Acest concept important în chimie este discutat mai detaliat mai jos.
Punct de control al înțelegerii
Un element este alcătuit din
Câteva dintre detaliile teoriei atomice a lui Dalton necesită mai multe explicații.
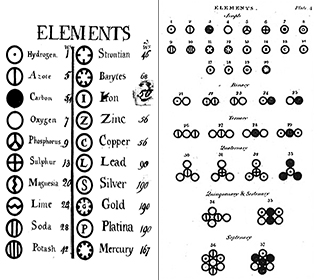
Elemente: Încă din 1660, Robert Boyle a recunoscut că definiția greacă a elementului (pământ, foc, aer și apă) nu era corectă. Boyle a propus o nouă definiție a elementului ca substanță fundamentală, iar în prezent definim elementele ca fiind substanțe fundamentale care nu pot fi descompuse mai departe prin mijloace chimice. Elementele sunt elementele constitutive ale universului. Ele sunt substanțe pure care stau la baza tuturor materialelor din jurul nostru. Unele elemente pot fi văzute în formă pură, cum ar fi mercurul dintr-un termometru; pe altele le vedem în principal în combinație chimică cu altele, cum ar fi oxigenul și hidrogenul din apă. În prezent, cunoaștem aproximativ 116 elemente diferite. Fiecărui element i se atribuie un nume și o abreviere de una sau două litere. Adesea, această abreviere este pur și simplu prima literă a elementului; de exemplu, hidrogenul este abreviat ca H, iar oxigenul ca O. Uneori, un element primește o abreviere din două litere; de exemplu, heliul este He. Atunci când se scrie abrevierea unui element, prima literă se scrie întotdeauna cu majusculă, iar cea de-a doua literă (dacă există) se scrie întotdeauna cu minusculă.
Atomii: O singură unitate a unui element se numește atom. Atomul este cea mai elementară unitate de bază a materiei, care compune totul în lumea din jurul nostru. Fiecare atom păstrează toate proprietățile chimice și fizice ale elementului său părinte. La sfârșitul secolului al XIX-lea, oamenii de știință aveau să demonstreze că atomii erau de fapt formați din bucăți mai mici, „subatomice”, ceea ce a spulberat conceptul de billiard al atomului (a se vedea modulul nostru Teoria atomică I: Primele zile).
Compuși: Cele mai multe dintre materialele cu care intrăm în contact sunt compuși, substanțe formate prin combinarea chimică a doi sau mai mulți atomi de elemente. O singură „particulă” a unui compus se numește moleculă. Dalton și-a imaginat în mod eronat că atomii se „agățau” împreună pentru a forma molecule. Cu toate acestea, Dalton a realizat corect că compușii au formule precise. Apa, de exemplu, este întotdeauna formată din două părți de hidrogen și o parte de oxigen. Formula chimică a unui compus se scrie prin enumerarea simbolurilor elementelor împreună, fără spații între ele. În cazul în care o moleculă conține mai mult de un atom al unui element, după simbol se înscrie un număr pentru a arăta numărul de atomi ai acelui element din moleculă. Astfel, formula pentru apă este H2O, niciodată HO sau H2O2.
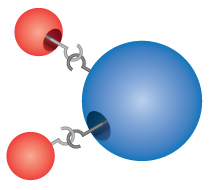
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.