Neutropenia
Lista cu toate cauzele potențiale ale neutropeniei nu este scurtă. Etiologia neutropeniei poate fi privită, din punct de vedere conceptual, în două mari moduri, în funcție de mecanism sau de categoria etiologică.
Mecanismele care cauzează neutropenia sunt variate și nu sunt complet înțelese. În multe cazuri, neutropenia apare după o expunere prelungită la un medicament sau la o altă substanță, ceea ce duce la scăderea producției de neutrofile de către măduva osoasă hipoplazică. Acest lucru sugerează un efect toxic direct asupra celulelor stem. În alte cazuri, este necesară o expunere repetată, dar intermitentă, la un medicament sau la o altă substanță. Acest lucru sugerează un mecanism imunitar, deși această idee nu a fost dovedită. În multe situații clinice, expunerea exactă și durata acesteia în relație cu debutul neutropeniei nu sunt cunoscute.
Având în vedere această înțelegere incompletă a mecanismelor neutropeniei, clasificarea pe categorii etiologice largi este mai simplu de reținut. În această schemă, etiologia neutropeniei poate fi clasificată ca fiind congenitală (ereditară) sau dobândită. Deși această clasificare poate avea o utilitate limitată pentru diagnosticul clinic, ea poate fi utilă pentru a separa clar cauzele ereditare ale neutropeniei de panoplia de cauze dobândite. În cadrul neutropeniilor ereditare, aceste afecțiuni pot fi descrise în continuare ca fiind asociate cu neutropenia izolată sau cu alte defecte, fie imune, fie fenotipice.
Multe afecțiuni ereditare se datorează unor mutații în gena care codifică elastaza neutrofilă, ELA2. Sunt implicate mai multe alele. Cele mai frecvente mutații sunt substituții intronice care inactivează un situs de racordare în intronul 4. Sunt implicate și alte gene în afară de ELA2. Tabelul de mai jos enumeră unele dintre afecțiunile genetice implicate; acestea sunt afecțiuni neobișnuite.
Tabel 1. Condiții genetice (ereditare) în agranulocitoză (Deschide tabelul într-o fereastră nouă)
|
Sindromul |
Inheritance |
Gene |
Clinical Features |
|
Cyclic neutropenia |
Autosomal dominant |
ELA2 |
Alternate 21-day cycling of neutrophils and monocytes |
|
Kostmann syndrome |
Autosomal recessive |
Unknown |
Stable neutropenia, no MDS or AML |
|
Severe congenital neutropenia |
Autosomal dominant |
ELA2 (35-84%) |
Stable neutropenia, MDS or AML |
|
Autosomal dominant |
GFI1 |
Stable neutropenia, circulating myeloid progenitors, lymphopenia |
|
|
Sex linked |
Wasp |
Neutropenic variant of Wiskott-Aldrich syndrome |
|
|
Autosomal dominant |
G-CSFR |
G-CSF–refractory neutropenia, no AML or MDS |
|
|
Hermansky-Pudlak syndrome type 2 |
Autosomal recessive |
AP3B1 |
Severe congenital neutropenia, platelet dense-body defect, oculocutaneous albinism |
|
Chediak-Higashi syndrome |
Autosomal recessive |
LYST |
Neutropenia, oculocutaneous albinism, giant lysosomes, impaired platelet function |
|
Barth syndrome |
Sex linked |
TAZ |
Neutropenia, often cyclic; cardiomyopathy, methylglutaconic aciduria |
|
Cohen syndrome |
Autosomal recessive |
COH1 |
Neutropenia, mental retardation, dysmorphism |
|
Source: Modified from Berliner et al, 2004. AML = acute myeloid leukemia; G-CSF = granulocyte colony-stimulating factor; MDS = myelodysplastic syndrome. |
|||
Cauzele neutropeniei dobândite sunt complexe, dar majoritatea sunt legate de trei categorii majore: infecții, medicamente (atât cele toxice directe cât și cele mediate imunitar) și autoimunitate. Neutropenia cronică benignă, sau neutropenia cronică idiopatică, pare a fi o tulburare care se suprapune cu formele ereditare și dobândite, fiind uneori imposibil de distins. Unii pacienți neutropenici prezintă un istoric clar și un tipar familial, în timp ce alții nu au un istoric familial, au puține determinări ale analizelor de sânge și o durată necunoscută a neutropeniei. Acest grup de pacienți ar putea avea neutropenie ereditară sau dobândită. Urmează un scurt rezumat al tulburărilor neutropenice congenitale și dobândite.
Nutropenia congenitală cu defecte imunitare asociate
Neutropenia cu imunoglobuline anormale este observată la persoanele cu agammaglobulinemie legată de X, deficit izolat de imunoglobulină A (IgA), sindromul hiperimunoglobulinei M legat de X (XHIGM) și disgammaglobulinemie de tip I. În cazul XHIGM, care se datorează unor mutații în ligandul CD40, pacienții pot avea de fapt niveluri normale sau ridicate de IgM, dar niveluri serice de IgG marcat scăzute. În toate aceste afecțiuni, riscul de infecție este ridicat, iar tratamentul este imunoglobulina intravenoasă (IVIG).
Pacienții cu disgenesie reticulară prezintă neutropenie severă, fără imunitate mediată celular, agammaglobulinemie și limfopenie. Apar infecții care pun viața în pericol și care sunt refractare la factorul de stimulare a coloniilor de granulocite (G-CSF). Transplantul de măduvă osoasă este tratamentul de elecție.
Neutropeniile congenitale sau cronice
Neutropenia congenitală severă (SCN), sau sindromul Kostmann, este cel mai adesea cauzată de o moștenire recesivă și se întâlnește la populații izolate, îndepărtate, cu un grad ridicat de consangvinitate. Au fost raportate, de asemenea, cazuri autosomal dominante și sporadice, cel mai adesea din cauza unor mutații în receptorul G-CSF. Nu există un defect genetic uniform în acest sindrom. Mutațiile în ELA2, care sunt cauzale pentru neutropenia ciclică (a se vedea mai jos), nu sunt suficiente pentru a explica fenotipul SCN de tip Kostmann.
Pacienții se prezintă până la vârsta de 3 luni cu infecții bacteriene recurente. Gura și perirectul sunt cele mai frecvente focare de infecție. Acest tip de neutropenie este severă, iar tratamentul este G-CSF. Riscul de conversie la sindrom mielodisplastic (SMD)/leucemie mielogenă acută (LMA) cu monosomia 7 după tratamente cu G-CSF este asociat cu mutații dobândite suplimentare. Cele mai multe dintre aceste cazuri sunt cauzate de o mutație în receptorul G-CSF. Pacienții a căror afecțiune răspunde clinic la G-CSF sunt tratați pe viață.
Câțiva pacienți cu alte forme de SCN par să aibă mutații în GFI1, o genă represoare transcripțională cu degete de zinc implicată în funcția celulelor stem hematopoietice și în deciziile de angajare a liniei.
Nutrepenia ciclică (NC) se caracterizează prin crize periodice de neutropenie asociate cu infecții, urmate de recuperarea numărului de neutrofile periferice. Periodicitatea sa este de aproximativ 21 de zile (interval, 12-35 d). Precursorii granulocitelor dispar din măduvă înainte de fiecare nadir neutrofilic din ciclu, din cauza apoptozei accelerate a celulelor progenitoare mieloide. Unele cazuri pot fi determinate genetic, cu o moștenire autosomal recesivă. Alte cazuri pot fi datorate unei moșteniri autosomal dominante. În unele cazuri sporadice de CN, pacienții prezintă mutații în ELA2.
Persoanele cu CN se prezintă de obicei ca sugari sau copii, dar există forme dobândite de CN la vârsta adultă. Prognosticul este bun, cu o evoluție benignă; cu toate acestea, 10% dintre pacienți vor prezenta infecții care le vor pune viața în pericol. Tratamentul pentru neutropenia ciclică este G-CSF zilnic.
Nutrepenia cronică benignă
Nutrepenia cronică benignă familială, sau neutropenia benignă etnică, este o afecțiune cu un tipar de moștenire autosomal dominant observată la descendenții africani, evrei yemeniți, evrei etiopieni, arabi, din Caraibe și din Indiile de Vest. La populațiile cu ascendență africană și evreiască yemenită, studiile genetice arată o asociere puternică cu un polimorfism mononucleotidic în gena DARC. Pacienții sunt de obicei asimptomatici, iar infecțiile sunt ușoare. Persoanele afectate cu neutropenie cronică benignă au un risc general scăzut de infecție și nu este necesară o terapie specifică.
În neutropeniile cronice benigne nonfamiliale, infecțiile ușoare cu o evoluție benignă caracterizează această afecțiune. Cu toate acestea, CNA răspunde la stres, cum ar fi infecția, corticosteroizii și catecolaminele.
Nutrepenia cronică severă idiopatică
Nutrepenia cronică severă idiopatică este un diagnostic de excludere. Pacienții afectați prezintă infecții și neutropenie severă.
Neutropenia asociată cu anomalii fenotipice
Sindromul Shwachman (Shwachman-Diamond) are un tipar de moștenire autosomal recesiv. Neutropenia este moderată până la severă, cu o rată de mortalitate de 15-25%, iar sindromul se prezintă în copilărie, cu infecții recurente, diaree și dificultăți în alimentație. Pot apărea nanism, condrodisplazie și insuficiență pancreatică exocrină.
Sindromul Shwachman-Diamond și diskeratoza congenitală legată de X (DC), hipoplazia cartilajului-părului (CHH) și anemia Diamond-Blackfan (DBA) par să aibă defecte genetice comune implicate în sinteza ribozomilor. Majoritatea cazurilor de sindrom Shwachman-Diamond sunt cauzate de mutații în gena SBDS. Funcția precisă a acestei gene este încă în curs de elucidare; cu toate acestea, ea este implicată în reacțiile de sinteză a ribozomilor și de procesare a ARN-ului. Tratamentul este G-CSF.
În cazul CHH, modelul de moștenire este autosomal recesiv pe cromozomul 9 și se observă în familiile Amish și finlandeze. CHH este cauzată de mutații în gena RMRP, care codifică componenta ARN a complexului de procesare a ribonucleazei ARN mitocondrial (RNase MRP). Neutropenia este moderată până la severă. CHH se prezintă cu defecte ale imunității mediate de celule, anemie macrocitară, afecțiuni gastrointestinale și nanism. De asemenea, prezintă o predispoziție la cancer, în special limfom. Tratamentul este transplantul de măduvă osoasă.
Diskeratoza congenitală (sindromul Zinsser-Cole-Engman) se prezintă cu retard mental, pancitopenie și imunitate mediată celulară defectuoasă. Diskeratoza congenitală este mai frecventă la bărbați decât la femei și este similară din punct de vedere hematologic cu anemia Fanconi. Diskeratoza congenitală este de obicei recesivă legată de X, deși există forme autosomal dominante și autosomal recesive ale acestei afecțiuni.
Forma recesivă legată de X a fost legată de mutații în DKC1, care codifică diskerina, o proteină nucleolară asociată cu particule de ribonucleoproteine. Forma autosomal dominantă este asociată cu mutații în altă genă, TERC, care face parte din telomerază. Telomeraza are atât o componentă proteică, cât și una ARN, iar TERC codifică componenta ARN. Pacienții cu această tulburare au telomeri mai scurți decât în mod normal. Tratamentul este reprezentat de G-CSF, factorul de stimulare a coloniilor de granulocite-macrofage (GM-CSF) și transplantul de măduvă osoasă.
Sindromul Barth este o tulburare recesivă legată de X care se prezintă cu cardiomiopatie în copilărie, miopatie scheletală, infecții recurente, nanism și neutropenie moderată până la severă.
Sindromul Chediak-Higashi este o tulburare autozomal recesivă cu infecții recurente, încetinire mentală, fotofobie, nistagmus, albinism oculocutanat, neuropatie, tulburări de sângerare, gingivită și granule lizozomiale în diverse celule. Neutropenia este moderată până la severă, iar tratamentul este transplantul de măduvă osoasă.
Myelokathexis
Myelokathexis se prezintă în copilărie cu neutropenie moderată și se asociază cu infecții recurente. Afecțiunea se datorează apoptozei accelerate și exprimării scăzute a bcl-x în precursorii neutrofilelor. Se observă un aspect nuclear anormal, cu hipersegmentare cu filoane nucleare, picnoză și vacuolizare citoplasmatică. Tratamentul este G-CSF și GM-CSF.
Sindromul leucocitelor leneșe
Sindromul leucocitelor leneșe este o neutropenie severă cu motilitate anormală a neutrofilelor asociată. Etiologia este necunoscută, iar tratamentul este de susținere în natură.
Tulburări metabolice
Este vorba de neutropenii cronice cu ANC-uri variabile. They include glycogen storage disease type 1b and various acidemias, such as isovaleric, propionic, and methylmalonic. In glycogen storage disease type 1b, the treatment is G-CSF and GM-CSF.
Acquired neutropenia caused by intrinsic bone marrow disease
Intrinsic bone marrow diseases that may cause neutropenia include the following:
-
Aplastic anemia
-
Hematologic malignancy (eg, leukemia, lymphoma, myelodysplasia, myeloma)
-
Ionizing radiation
-
Tumor infiltration
-
Granulomatous infection
-
Myelofibrosis
Immune-mediated neutropenia
A drug may act as a hapten and induce antibody formation. This mechanism operates in cases due to gold, aminopyrine, and antithyroid drugs. The antibodies destroy the granulocytes and may not require the continued presence of the drug for their action. Alternatively, the drug may form immune complexes that attach to the neutrophils. This mechanism operates with quinidine.
Drug immune-mediated neutropenia may be caused by the following:
-
Aminopyrine
-
Quinidine
-
Cephalosporins
-
Penicillins
-
Sulfonamides
-
Phenothiazines
-
Hydralazine
Other medications have been implicated
Autoimmune neutropenia is the neutrophil analogue of autoimmune hemolytic anemia and of idiopathic thrombocytopenic neutropenia. It should be considered in the absence of any of the common causes. Antineutrophil antibodies have been demonstrated in these patients. Autoimmune neutropenia may be associated with the following:
-
Rheumatoid arthritis (with or without Felty syndrome)
-
Sjögren syndrome
-
Chronic, autoimmune hepatitis
-
Systemic lupus erythematosus
-
Thymoma
-
Goodpasture disease
-
Granulomatosis with polyangiitis (Wegener granulomatosis)
-
Pure red blood cell (RBC) aplasia, in which there is complete disappearance of granulocyte tissue from the bone marrow; pure RBC dysplasia is a rare disorder due to the presence of antibody-mediated, granulocyte-macrophage colony forming unit (GM-CFU) inhibitory activity, and it is often associated with thymoma
-
Transfusion reactions, which can be caused by the surface antigens of neutrophilia; beneficiarii de transfuzii repetate de granulocite ar putea deveni aloimunizați
-
Proliferarea limfocitelor granulare mari sau leucemie
În neutropenia neonatală izoimună, mama produce anticorpi antineutrofile IgG la antigene neutrofile fetale care sunt recunoscute ca nonself. Acest lucru apare la 3% dintre nașterile vii. Tulburarea se manifestă prin febră neonatală, infecții ale tractului urinar, celulită, pneumonie și sepsis. Durata neutropeniei este de obicei de 7 săptămâni.
Nutrepenia autoimună cronică se observă la adulți și nu are predilecție de vârstă. Până la 36% dintre pacienți vor prezenta anticorpi antineutrofile serici, iar evoluția clinică este de obicei mai puțin severă. Pacienții pot avea această afecțiune în asociere cu lupusul eritematos sistemic, artrita reumatoidă, granulomatoza Wegener și hepatita cronică.
Dacă neutropenia autoimună cronică este asociată cu aceste boli, corticosteroizii sunt indicați ca tratament. La nou-născuți și copii, această tulburare este asociată cu un risc mai scăzut de infecție și cu infecții mai ușoare care implică urechea medie, tractul gastrointestinal și pielea.
Limfocitoza T-gamma, sau tulburare limfoproliferativă, este o boală clonală a limfocitelor T CD3+ sau a celulelor natural killer (NK) CD3- care infiltrează măduva osoasă și țesuturile. Cunoscută și sub denumirea de leucemie a limfocitelor cu granule mari (LGL-leucemie), limfocitoza T-gamma poate fi asociată cu poliartrita reumatoidă și este asociată cu anticorpi antineutrofile cu titru ridicat. Neutropenia este persistentă și severă. Tratamentul este adesea de natură suportivă, dar este, de asemenea, îndreptat spre eliminarea populației clonale.
Nutoneopenia dobândită cauzată de infecții
Infecțiile sunt cea mai frecventă formă de neutropenie dobândită. Infecțiile care pot provoca neutropenie includ, dar nu se limitează la următoarele:
-
Bacterial sepsis
-
Viral infections (eg, influenza, measles, Epstein Barr virus , cytomegalovirus , viral hepatitis, human immunodeficiency virus -1) (see first image below)
-
Toxoplasmosis
-
Brucellosis
-
Typhoid
-
Tuberculosis (see second and third images below)
-
Malaria
-
Dengue fever
-
Rickettsial infection
-
Babesiosis
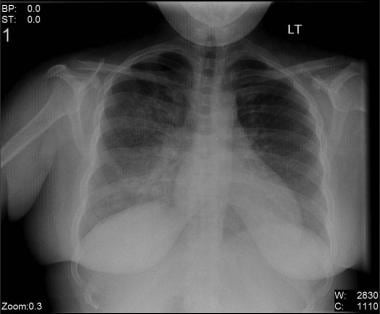 Bilateral interstitial infiltrates in a 31-year-old patient with influenza pneumonia.
Bilateral interstitial infiltrates in a 31-year-old patient with influenza pneumonia. 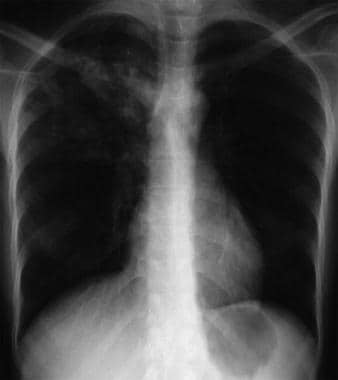 Anteroposterior chest radiograph in a young ED patient presenting with cough and malaise. The radiograph shows a classic posterior segment right upper lobe density consistent with active tuberculosis. Această femeie a fost internată în izolare și a început empiric cu un regim de 4 medicamente la urgență. Tuberculoza a fost confirmată la testarea sputei. Pentru imagine, mulțumim Remote Medicine, remotemedicine.org.
Anteroposterior chest radiograph in a young ED patient presenting with cough and malaise. The radiograph shows a classic posterior segment right upper lobe density consistent with active tuberculosis. Această femeie a fost internată în izolare și a început empiric cu un regim de 4 medicamente la urgență. Tuberculoza a fost confirmată la testarea sputei. Pentru imagine, mulțumim Remote Medicine, remotemedicine.org. 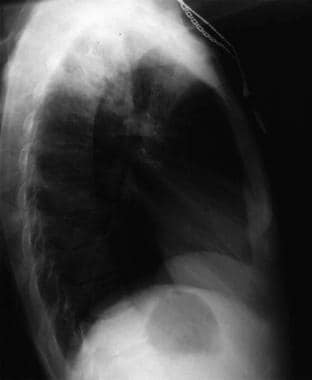 Radiografie toracică laterală la un pacient de 31 de ani cu pneumonie gripală. Imagine oferită de Remote Medicine, remotemedicine.org.
Radiografie toracică laterală la un pacient de 31 de ani cu pneumonie gripală. Imagine oferită de Remote Medicine, remotemedicine.org.
Cele mai frecvent implicate sunt organisme din flora endogenă. Organismele Staphylococcus aureus sunt întâlnite în cazurile de infecții cutanate. Organismele Gram-negative sunt observate în infecții ale tractului urinar și gastrointestinal, în special Escherichia coli și speciile Pseudomonas. Pot apărea, de asemenea, infecții cu Candida albicans. În cavitatea bucală se poate găsi o floră mixtă.
Infecțiile virale duc adesea la neutropenie ușoară sau moderată. Agranulocitoza este mai puțin frecventă, dar poate apărea. Cele mai frecvente organisme sunt virusul Epstein-Barr, virusul hepatitei B, virusul febrei galbene, citomegalovirusul și gripa. Multe infecții copleșitoare, atât virale cât și bacteriene, pot cauza neutropenie severă.
Nutrepenia dobândită cauzată de deficiența nutrițională
Deficiențele nutriționale care pot cauza neutropenie includ vitamina B-12, folat și deficiența de cupru.
Nutrepenia dobândită cauzată de medicamente și substanțe chimice, cu excepția chimioterapiei citotoxice
Numeroase medicamente au fost asociate cu neutropenia. Categoriile cu cel mai mare risc sunt medicamentele antitiroidiene, macrolidele și procainamidele. După cum s-a afirmat mai sus, multe medicamente acționează printr-un mecanism mediat imunitar. Cu toate acestea, unele medicamente par să aibă efecte toxice directe asupra celulelor stem ale măduvei sau asupra precursorilor neutrofilelor din compartimentul mitotic. De exemplu, medicamente precum antipsihoticele și antidepresivele și cloramfenicolul pot acționa ca toxine directe la unele persoane, pe baza metabolismului și a sensibilității în acest mod. Alte medicamente pot avea o combinație de mecanisme imune și neimune sau pot avea mecanisme de acțiune necunoscute.
Antimicrobienele includ penicilina, cefalosporinele, vancomicina, cloramfenicolul, gentamicina, clindamicina, doxiciclina, flucitosina, nitrofurantoina, novobiocina, minociclina, griseofulvina, lincomicina, metronidazolul, rifampicina, izoniazida, streptomicina, tiacetazonă, mebendazol, pirimetamină, levamisol, ristocetină, sulfonamide, clorochină, hidroxiclorochină, chinacrină, etambutol, dapsone, ciprofloxacină, trimetoprim, imipenem/cilastatină, zidovudină, fludarabină, aciclovir și terbinafină.
Analgezicele și agenții antiinflamatori includ aminopirina, dipirina, indometacinul, ibuprofenul, acidul acetilsalicilic, diflunisalul, sulindacul, tolmetinul, benoxaprofenul, barbituricele, mezalazina și chinina.
Antipsihoticele, antidepresivele și agenții neurofarmacologici includ fenotiazinele (clorpromazina, metilpromazina, mepazina, promazina, tioridazina, proclorperazina, trifluoperazina, trimeprazina), clozapina, risperidona, imipramină, desipramină, diazepam, clordiazepoxid, amoxapină, meprobamat, tiotixen și haloperidol.
Anticonvulsivantele includ acidul valproic, fenitoina, trimetadiona, mefenitoina (Mesantoin), etosuximida și carbamazepina.
Medicamentele antitiroidiene includ tiouracilul, propiltiouracilul, metimazolul, carbimazolul, percloratul de potasiu și tiocianatul.
Medicamentele cardiovasculare includ procainamidă, captopril, aprindină, propranolol, hidralazină, metildopa, chinidină, diazoxid, nifedipină, propafenonă, ticlopidină și vesnarinonă.
Antihistaminicele includ cimetidina, ranitidina, tripelennamina (Pyribenzamina), metafenilena, thenalidina, bromfeniramina și mianserina.
Diureticele includ acetazolamida, bumetanida, clorotiazida, hidroclorotiazida, clortalidona, metazolamida și spironolactona.
Agenții hipoglicemianți includ clorpropamida și tolbutamida.
Medicamentele antimalarice includ amodiachina, dapsona, hidroxiclorochina, pirimetamina și chinina.
Medicamentele diverse includ alopurinol, colchicină, aminoglutetimidă, famotidină, bezafibrat, flutamidă, tamoxifen, penicilamină, acid retinoic, metoclopramid, fenindionă, dinitrofenol, acid etacrimic, diclorodifeniltricloroetan (DDT), cinchofen, antimoniu, piritildionă, rauwolfia, etanol, clorpropamidă, tolbutamidă, tiazide, spironolactonă, methazolamidă, acetazolamidă, IVIG și levodopa.
Metalele grele includ aurul, arsenicul și mercurul.
Expunerea la medicamente sau substanțe chimice este cea mai frecventă cauză a agranulocitozei: aproximativ o jumătate dintre pacienți au un istoric de expunere la medicamente sau substanțe chimice. Orice substanță chimică sau medicament care poate deprima măduva osoasă și poate provoca hipoplazie sau aplasie este capabil să provoace agranulocitoză. Unele medicamente fac acest lucru la toată lumea dacă sunt administrate în doze suficient de mari. Alți agenți par să provoace reacții idiosincratice care afectează doar anumite persoane susceptibile.
Câțiva agenți (de exemplu, acidul valproic, carbamazepina și antibioticele beta-lactamice) acționează prin inhibarea directă a mielopoiezei. În culturile de măduvă osoasă, acești agenți inhibă formarea de colonii de granulocite într-o manieră legată de doză. Afectarea directă a micro-mediului măduvei osoase sau a precursorilor mieloizi joacă un rol în majoritatea celorlalte cazuri.
Multe medicamente asociate cu agranulocitoza au fost raportate la US Food and Drug Administration (FDA) în cadrul cerinței sale de raportare a reacțiilor adverse. Mulți agenți sunt, de asemenea, raportați la un registru menținut de Asociația Medicală Americană (AMA). Medicamentele raportate au fost utilizate singure, în combinație cu un alt medicament cunoscut ca fiind potențial toxic sau cu un alt medicament fără toxicitate cunoscută. Mai multe medicamente sunt deosebit de importante din cauza frecvenței ridicate a asocierii lor cu agranulocitoza. Acestea includ următoarele:
-
Phenothiazine
-
Antithyroid drugs (thiouracil and propylthiouracil)
-
Aminopyrine
-
Chloramphenicol
-
Sulfonamides
Miscellaneous immunologic neutropenias
Immunologic neutropenias may occur after bone marrow transplantation and blood product transfusions.
Felty syndrome is a syndrome of rheumatoid arthritis, splenomegaly, and neutropenia. Splenectomy shows an initial response, but neutropenia may recur in 10-20% of patients. Treatment is directed toward rheumatoid arthritis.
In complement activation–mediated neutropenia, hemodialysis, cardiopulmonary bypass, and extracorporeal membrane oxygenation (ECMO) expose blood to artificial membranes and can cause complement activation with subsequent neutropenia.
In splenic sequestration, the degree of neutropenia resulting from this process is proportional to the severity of the splenomegaly and the bone marrow’s ability to compensate for the reduction in circulating bands and neutrophils.
Eosinopenia and basophilopenia
Eosinopenia may be associated with the following:
-
Acute bacterial infection
-
Glucocorticoid administration
-
Physical stress
-
Thymoma
Decreased circulating basophils may be associated with the following:
-
Anaphylaxis
-
Acute infection
-
Drug-induced hypersensitivity
-
Congenital absence of basophils
-
Hemorrhage
-
Hyperthyroidism
-
Ionizing radiation
-
Neoplasia
-
Ovulation
-
Urticaria
-
Drugs (eg, corticosteroid, adrenocorticotropic hormone therapy, chemotherapeutic agents, thyroid hormones)
Go to Pediatric Autoimmune and Chronic Benign Neutropenia for complete information on this topic.
 Bilateral interstitial infiltrates in a 31-year-old patient with influenza pneumonia.
Bilateral interstitial infiltrates in a 31-year-old patient with influenza pneumonia.  Anteroposterior chest radiograph in a young ED patient presenting with cough and malaise. The radiograph shows a classic posterior segment right upper lobe density consistent with active tuberculosis. Această femeie a fost internată în izolare și a început empiric cu un regim de 4 medicamente la urgență. Tuberculoza a fost confirmată la testarea sputei. Pentru imagine, mulțumim Remote Medicine, remotemedicine.org.
Anteroposterior chest radiograph in a young ED patient presenting with cough and malaise. The radiograph shows a classic posterior segment right upper lobe density consistent with active tuberculosis. Această femeie a fost internată în izolare și a început empiric cu un regim de 4 medicamente la urgență. Tuberculoza a fost confirmată la testarea sputei. Pentru imagine, mulțumim Remote Medicine, remotemedicine.org.  Radiografie toracică laterală la un pacient de 31 de ani cu pneumonie gripală. Imagine oferită de Remote Medicine, remotemedicine.org.
Radiografie toracică laterală la un pacient de 31 de ani cu pneumonie gripală. Imagine oferită de Remote Medicine, remotemedicine.org.