Principii de biologie
După ce am învățat că reacțiile chimice eliberează energie atunci când legăturile care stochează energie sunt rupte, următoarea întrebare importantă este următoarea: Cum este cuantificată și exprimată energia asociată cu aceste reacții chimice? Cum poate fi comparată energia eliberată de o reacție cu cea a unei alte reacții? Pentru a cuantifica aceste transferuri de energie se utilizează o măsurătoare a energiei libere. Reamintim că, în conformitate cu a doua lege a termodinamicii, toate transferurile de energie implică pierderea unei anumite cantități de energie într-o formă inutilizabilă, cum ar fi căldura. Energia liberă se referă în mod specific la energia asociată unei reacții chimice care este disponibilă după ce pierderile sunt luate în considerare. Cu alte cuvinte, energia liberă este energia utilizabilă sau energia care este disponibilă pentru a efectua muncă. Privind acest concept în sens biologic, energia liberă este energia dintr-o moleculă care poate fi utilizată pentru a efectua muncă. Glucoza are o cantitate mare de energie liberă, deoarece există o cantitate mare de energie stocată în legăturile moleculei de glucoză. Dioxidul de carbon are o energie liberă mult mai mică, deoarece există mult mai puțină energie stocată în legăturile sale.
Dacă se eliberează energie în timpul unei reacții chimice, atunci modificarea energiei libere rezultată din transformarea reactanților în produse, semnificată ca ΔG (delta G) va fi un număr negativ. O modificare negativă a energiei libere înseamnă, de asemenea, că produsele reacției au mai puțină energie liberă decât reactanții, deoarece aceștia eliberează o parte din energia liberă în timpul reacției. Reacțiile care au o variație negativă a energiei libere și care, în consecință, eliberează energie liberă se numesc reacții exergonice. Gândiți-vă: exergonice înseamnă că energia iese din sistem. Aceste reacții sunt, de asemenea, denumite reacții spontane, iar produsele lor au mai puțină energie stocată decât reactanții. Trebuie făcută o distincție importantă între termenul spontan și ideea că o reacție chimică are loc imediat. Contrar utilizării cotidiene a termenului, o reacție spontană nu este una care se produce brusc sau rapid. Ruginirea fierului este un exemplu de reacție spontană care se produce încet, puțin câte puțin, în timp.
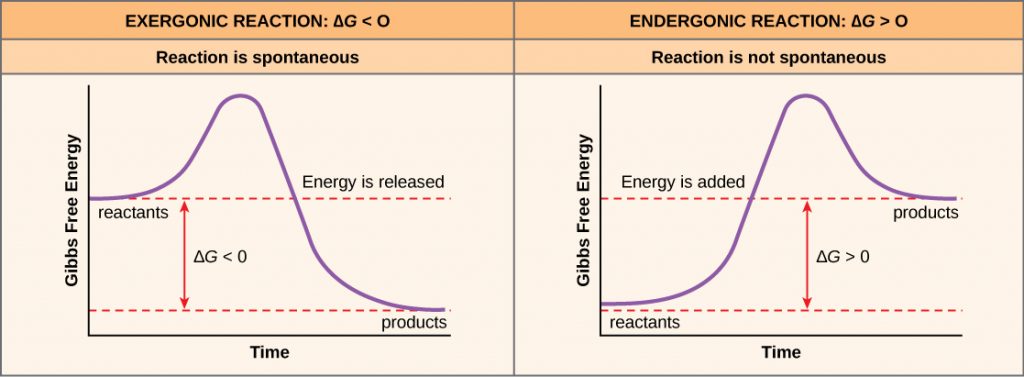
Dacă o reacție chimică absoarbe energie mai degrabă decât eliberează energie în echilibru, atunci ΔG pentru acea reacție va fi o valoare pozitivă. În acest caz, produsele au mai multă energie liberă decât reactanții. Astfel, produșii acestor reacții pot fi considerați ca fiind molecule care stochează energie. Aceste reacții chimice se numesc reacții endergonice și sunt nespontane.
O reacție endergonică nu va avea loc de la sine fără adaos de energie liberă.

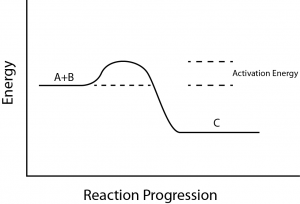
Există un alt concept important care trebuie luat în considerare în ceea ce privește reacțiile endergonice și exergonice. Reacțiile exergonice necesită o cantitate mică de aport de energie pentru a porni, înainte de a putea continua cu etapele de eliberare a energiei.
Aceste reacții au o eliberare netă de energie, dar necesită totuși un anumit aport de energie la început. Această cantitate mică de aport de energie necesară pentru ca toate reacțiile chimice să aibă loc se numește energie de activare (figura 3).
Dacă nu se specifică altfel, imaginile de pe această pagină sunt licențiate sub CC-BY 4.0 de OpenStax.
Text adaptat din: OpenStax, Concepts of Biology. OpenStax CNX. May 18, 2016 http://cnx.org/contents/[email protected]
.