Datos sobre el flúor
El elemento más reactivo de la Tabla Periódica, el flúor tiene una historia violenta en la búsqueda de su descubrimiento. A pesar de las difíciles y a veces explosivas propiedades del flúor, es un elemento vital para los seres humanos y los animales, por lo que es habitual encontrarlo en el agua potable y la pasta de dientes.
Sólo los datos
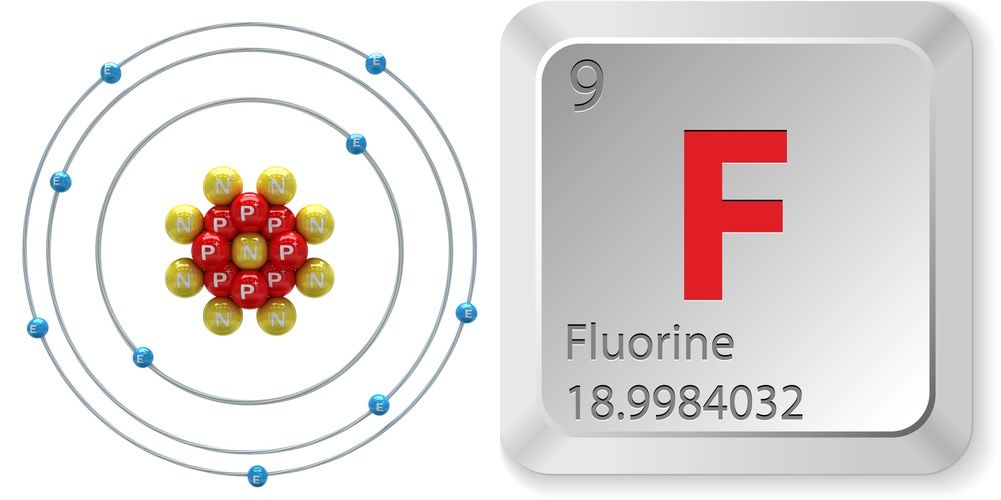
- Número atómico (número de protones en el núcleo): 9
- Símbolo atómico (en la Tabla Periódica de los Elementos): F
- Peso atómico (masa media del átomo): 18,998
- Densidad: 0,001696 gramos por centímetro cúbico
- Fase a temperatura ambiente: Gas
- Punto de fusión: menos 363,32 grados Fahrenheit (menos 219,62 grados Celsius)
- Punto de ebullición: menos 306,62 grados F (menos 188,12 grados C)
- Número de isótopos (átomos del mismo elemento con diferente número de neutrones): 18
- Isótopos más comunes: F-19 (100 por ciento de abundancia natural)
Historia
Los primeros químicos intentaron durante años aislar el elemento a partir de varios fluoruros. No fue hasta 1986 que el químico alemán Karl O. Christie sintetizó con éxito el flúor, e informó de sus resultados en la revista Inorganic Chemistry. El flúor no se encuentra libre en la naturaleza; pero en 2012, los investigadores encontraron pequeñas cantidades de flúor atrapadas en la antozonita, un tipo de fluorita radiactiva.
Durante siglos, el mineral fluorita se utilizó en el refinado de metales. Conocido hoy como fluoruro de calcio (CaF2), se utilizaba como fundente para separar el metal puro de los minerales no deseados del mineral, según Chemicool. El «fluor» viene de la palabra latina «fluere», que significa «fluir», porque eso es lo que la fluorita permitía hacer a los metales. El mineral también se llamaba esmeralda de Bohemia y se utilizaba en el grabado del vidrio, según el Laboratorio Jefferson.
Muchos científicos a lo largo de las décadas intentaron experimentar con la fluorita para conocer mejor sus propiedades, así como su composición. En sus experimentos, los químicos solían producir ácido flúor (hoy conocido como ácido fluorhídrico, HF), un ácido increíblemente reactivo y peligroso. Incluso pequeñas salpicaduras de este ácido en la piel pueden ser mortales, según Chemicool. Varios científicos resultaron heridos, cegados o muertos en algunos de los experimentos.
A principios del siglo XIX, los científicos Andre-Marie Ampere, en Francia, y Humphry Davy, en Inglaterra, mantuvieron correspondencia sobre la posibilidad de un nuevo elemento dentro del ácido. En 1813, Davy anunció el descubrimiento del nuevo elemento y lo denominó flúor a partir de la sugerencia de Ampere.
Henri Moissan, un químico francés, aisló finalmente el flúor en 1886 – después de ser envenenado varias veces en su búsqueda. Fue galardonado con el Premio Nobel en 1906 por el aislamiento del flúor mediante la electrólisis del fluoruro de hidrógeno de potasio seco (KHF2) y el ácido fluorhídrico seco.
Usos del flúor
Durante muchos años, las sales de flúor, o fluoruros, se han utilizado en la soldadura y para escarchar el vidrio, según la Royal Society. Por ejemplo, el ácido fluorhídrico se utiliza para grabar el vidrio de las bombillas.
El flúor es un elemento vital en la industria de la energía nuclear, según la Royal Society. Se utiliza para fabricar hexafluoruro de uranio, necesario para separar los isótopos del uranio. El hexafluoruro de azufre es un gas que se utiliza para aislar los transformadores eléctricos de alta potencia.
Los clorofluorocarbonos (CFC) se utilizaban antes en aerosoles, frigoríficos, aparatos de aire acondicionado, envases de espuma para alimentos y extintores. Estos usos están prohibidos desde 1996 porque contribuyen al agotamiento de la capa de ozono, según los Institutos Nacionales de Salud. Antes de 2009, los CFC se utilizaban en inhaladores para controlar el asma, pero esos tipos de inhaladores se eliminaron en 2013.
El flúor se utiliza en muchos productos químicos fluorados, incluidos los disolventes y los plásticos de alta temperatura, como el teflón (poli(tetrafluoroeteno), PTFE). El teflón es muy conocido por sus propiedades antiadherentes y se utiliza en sartenes. También se utiliza para el aislamiento de cables, para la cinta de fontanero y como base del Gore-Tex® (utilizado en el calzado y la ropa impermeable).
El flúor se añade al suministro de agua de las ciudades en una proporción de aproximadamente una parte por millón para ayudar a prevenir la caries dental, según el Jefferson Lab. Varios compuestos de flúor se añaden a la pasta de dientes, también para ayudar a prevenir la caries.
Impactos del flúor en la salud y el medio ambiente
Aunque todos los seres humanos y animales están expuestos a cantidades mínimas de flúor y las necesitan, el elemento en cualquier dosis suficientemente grande es extremadamente tóxico y peligroso. Según Lenntech, el flúor puede encontrarse de forma natural en el agua, el aire y los alimentos de origen vegetal y animal en pequeñas cantidades. Las cantidades más grandes de flúor se encuentran en algunos productos alimenticios como el té y el marisco.
Aunque pequeñas cantidades de flúor son esenciales para mantener la fortaleza de nuestros huesos y dientes, un exceso puede tener el efecto contrario de provocar osteoporosis o caries, así como dañar potencialmente los riñones, los nervios y los músculos.
En su forma gaseosa, el flúor es increíblemente peligroso. Pequeñas cantidades de gas flúor pueden causar irritación ocular y nasal, mientras que cantidades mayores pueden ser mortales, según Lenntech. El ácido fluorhídrico, como otro ejemplo, también puede resultar mortal cuando se produce incluso una pequeña salpicadura en la piel, según Chemicool.
En el medio ambiente, el flúor, el decimotercer elemento más abundante en la corteza terrestre, suele asentarse en el suelo y se combina fácilmente con la tierra, la roca, el carbón y la arcilla, según Lenntech. Las plantas pueden absorber el flúor del suelo, aunque las concentraciones elevadas pueden provocar daños. El maíz y los albaricoques, por ejemplo, se encuentran entre las plantas más susceptibles de sufrir daños y reducir su crecimiento cuando se exponen a niveles elevados de flúor.
¿Quién lo iba a decir?
- Debido a que el flúor es el elemento químicamente más reactivo, debe manipularse con extremo cuidado, ya que a veces puede explotar en contacto con todos los demás elementos, excluyendo el oxígeno, el helio, el neón y el criptón, según Chemicool.
- La lana de acero estalla en llamas cuando se expone al flúor, según la Real Sociedad de Química.
- El flúor es también el elemento más electronegativo. El flúor atrae los electrones más fácilmente que cualquier otro elemento.
- En promedio, la cantidad de flúor en el cuerpo humano es de tres miligramos.
- El flúor se extrae principalmente en China, Mongolia, Rusia, México y Sudáfrica, según Minerals Education Coalition.
- El flúor se crea en estrellas similares al sol hacia el final de su vida, según un artículo de 2014 publicado en la revista Astrophysical Journal Letters. El elemento se forma bajo las mayores presiones y temperaturas dentro de la estrella cuando se expande para convertirse en una gigante roja. Cuando las capas exteriores de la estrella son empujadas creando una nebulosa planetaria, el flúor viaja junto con los otros gases hacia el medio interestelar formando finalmente nuevas estrellas y planetas.
- Según el Journal of Chemistry, aproximadamente el 25 por ciento de los fármacos y medicamentos, incluidos los destinados al cáncer, el sistema nervioso central y el sistema cardiovascular, contienen alguna forma de flúor.
Investigación actual
Aunque el flúor puede ser tóxico cuando la concentración dentro del cuerpo es demasiado alta, también puede ser un elemento beneficioso para incluir en los medicamentos contra el cáncer, según un artículo de 2018 publicado en el Journal of Fluorine Chemistry. Según la investigación, la sustitución de los enlaces carbono-hidrógeno o carbono-oxígeno por un enlace carbono-flúor en los componentes activos del fármaco suele mostrar una mejora de la eficacia de los mismos, incluyendo una mayor estabilidad metabólica, una mayor unión a las moléculas diana y una mayor permeabilidad de la membrana. Se espera que con el aumento de la eficacia de los fármacos, junto con los fármacos diana específicos para el tumor o los sistemas de administración de fármacos dirigidos, la calidad de vida de los pacientes con cáncer pueda mejorar en gran medida con respecto a los métodos tradicionales, como la quimioterapia, en la que las células cancerosas, así como las células sanas, son el objetivo de los fármacos.
Esta nueva generación de fármacos para combatir el cáncer, así como las sondas de flúor para administrar los fármacos, se ha probado contra las células madre del cáncer y ha demostrado ser prometedora en la orientación y la lucha contra las células madre del cáncer, según el estudio. Los investigadores descubrieron que los fármacos que incluían flúor eran varias veces más activos contra diversas células madre cancerosas y mostraban una mayor estabilidad que los fármacos tradicionales para combatir el cáncer.