Feiten over fluor
Het meest reactieve element op het Periodiek Systeem, fluor heeft een heftige geschiedenis in de zoektocht naar zijn ontdekking. Ondanks de moeilijke en soms explosieve eigenschappen van fluor, is het een essentieel element voor mens en dier, en daarom wordt het vaak aangetroffen in drinkwater en tandpasta.
Alleen de feiten
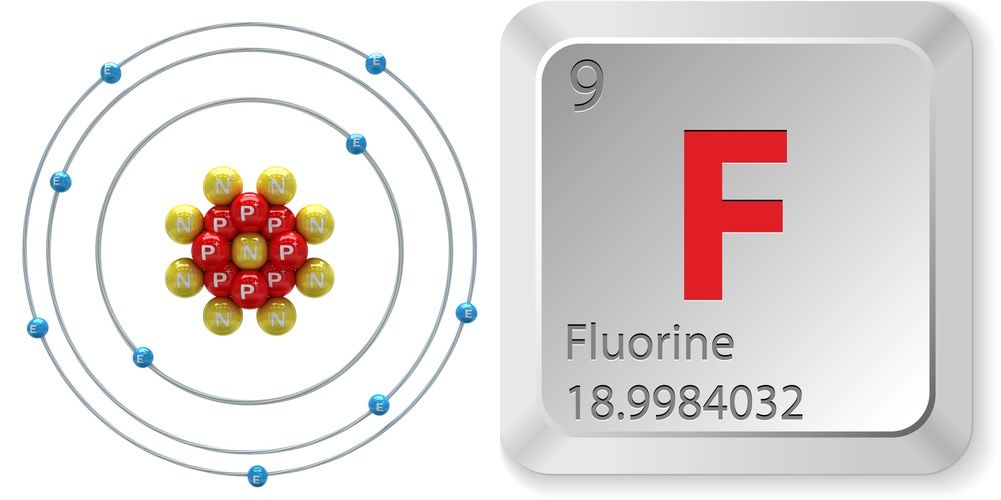
- Atoomnummer (aantal protonen in de kern): 9
- Atoomsymbool (in het Periodiek Systeem der Elementen): F
- Atomair gewicht (gemiddelde massa van het atoom): 18,998
- Dichtheid: 0,001696 gram per kubieke centimeter
- Fase bij kamertemperatuur: Gas
- Smeltpunt: min 363,32 graden Fahrenheit (min 219,62 graden Celsius)
- Kookpunt: min 306,62 graden F (min 188,12 graden C)
- Aantal isotopen (atomen van hetzelfde element met een verschillend aantal neutronen): 18
- Meest voorkomende isotopen: F-19 (100 procent natuurlijke abundantie)
Geschiedenis
Eerdere chemici probeerden jarenlang het element te isoleren uit verschillende fluoriden. Pas in 1986 slaagde de Duitse scheikundige Karl O. Christie erin fluor te synthetiseren en rapporteerde zijn resultaten in het tijdschrift Inorganic Chemistry. Fluor komt niet vrij voor in de natuur; maar in 2012 vonden onderzoekers kleine hoeveelheden fluor gevangen in antozoniet, een soort radioactief fluoriet.
Eeuwenlang werd het mineraal fluorspar gebruikt bij de raffinage van metalen. Tegenwoordig bekend als calciumfluoride (CaF2), werd het gebruikt als een flux om zuiver metaal te scheiden van de ongewenste mineralen in erts, aldus Chemicool. Het woord “fluor” komt van het Latijnse woord “fluere”, dat “stromen” betekent, omdat fluorspar metalen in staat stelde te stromen. Het mineraal werd ook wel Boheems smaragd genoemd en werd gebruikt bij het etsen van glas, aldus het Jefferson Laboratory.
Vele wetenschappers hebben in de loop der decennia geprobeerd met vloeispaat te experimenteren om de eigenschappen ervan beter te leren kennen, evenals de samenstelling. Bij hun experimenten produceerden chemici vaak fluoridezuur (tegenwoordig bekend als fluorwaterstofzuur, HF), een ongelooflijk reactief en gevaarlijk zuur. Zelfs kleine spatten van dit zuur op de huid kunnen dodelijk zijn, aldus Chemicool. Bij sommige experimenten zijn wetenschappers gewond geraakt, verblind of gedood.
In het begin van de 19e eeuw correspondeerden de wetenschappers Andre-Marie Ampere, in Frankrijk, en Humphry Davy, in Engeland, over de mogelijkheid van een nieuw element in het zuur. In 1813 kondigde Davy de ontdekking van het nieuwe element aan en gaf het op voorstel van Ampere de naam fluor.
Henri Moissan, een Franse chemicus, isoleerde uiteindelijk fluor in 1886 – nadat hij in zijn achtervolging verschillende malen vergiftigd was. Hij kreeg de Nobelprijs in 1906 voor het isoleren van fluor door elektrolyse van droog kaliumwaterstoffluoride (KHF2) en droog fluorwaterstofzuur.
Toepassingen van fluor
Fluorzouten, of fluoriden, worden al vele jaren gebruikt bij het lassen en voor het glazuren van glas, aldus de Royal Society. Fluorwaterstofzuur wordt bijvoorbeeld gebruikt om het glas van gloeilampen te etsen.
Fluor is een vitaal element in de kernenergie-industrie, aldus de Royal Society. Het wordt gebruikt om uraniumhexafluoride te maken, dat nodig is om uraniumisotopen te scheiden. Zwavelhexafluoride is een gas dat wordt gebruikt om krachtige elektriciteitstransformatoren te isoleren.
Chloorfluorkoolwaterstoffen (CFK’s) werden vroeger gebruikt in spuitbussen, koelkasten, airconditioners, schuimverpakkingen voor levensmiddelen en brandblussers. Die toepassingen zijn sinds 1996 verboden omdat ze bijdragen tot de aantasting van de ozonlaag, aldus het National Institutes of Health. Vóór 2009 werden CFK’s gebruikt in inhalatoren om astma onder controle te houden, maar die soorten inhalatoren werden in 2013 geleidelijk geëlimineerd.
Fluor wordt gebruikt in veel fluorchemicaliën, waaronder oplosmiddelen en kunststoffen die bij hoge temperaturen worden gebruikt, zoals teflon (poly(tetrafluorethyleen), PTFE). Teflon is bekend om zijn antikleefeigenschappen en wordt gebruikt in braadpannen. Het wordt ook gebruikt voor kabelisolatie, loodgieterstape en als basis voor Gore-Tex® (gebruikt in waterdichte schoenen en kleding).
Fluoride wordt in de verhouding van ongeveer één deel per miljoen toegevoegd aan de watervoorziening van steden om tandbederf te helpen voorkomen, aldus het Jefferson Lab. Verschillende fluorideverbindingen worden aan tandpasta toegevoegd, ook om tandbederf te helpen voorkomen.
Gevolgen van fluor voor gezondheid en milieu
Hoewel alle mensen en dieren worden blootgesteld aan en behoefte hebben aan minieme hoeveelheden fluor, is het element in een voldoende grote dosis extreem giftig en gevaarlijk. Volgens Lenntech komt fluor van nature in kleine hoeveelheden voor in water, lucht, en zowel plantaardig als dierlijk voedsel. Grotere hoeveelheden fluor komen voor in enkele voedingsmiddelen zoals thee en schaaldieren.
Hoewel kleine hoeveelheden fluor essentieel zijn voor het behoud van de sterkte van onze botten en tanden, kan een teveel aan fluor het omgekeerde effect hebben: het veroorzaken van osteoporose of tandbederf, maar het kan ook schadelijk zijn voor de nieren, zenuwen en spieren.
In zijn gasvorm is fluor ongelooflijk gevaarlijk. Kleine hoeveelheden fluorgas kunnen irritatie aan ogen en neus veroorzaken, terwijl grotere hoeveelheden dodelijk kunnen zijn, aldus Lenntech. Fluorwaterstofzuur, als een ander voorbeeld, kan ook dodelijk zijn als er zelfs maar een klein beetje op de huid terecht komt, volgens Chemicool.
In het milieu slaat fluor, het 13e meest voorkomende element in de aardkorst, neer in de bodem en verbindt zich gemakkelijk met aarde, rots, steenkool en klei, volgens Lenntech. Planten kunnen het fluor uit de bodem opnemen, hoewel hoge concentraties tot schade kunnen leiden. Maïs en abrikozen, bijvoorbeeld, behoren tot de planten die het meest gevoelig zijn voor schade en groeivermindering bij blootstelling aan hoge niveaus van fluor.
Wie wist het?
- Omdat fluor het chemisch meest reactieve element is, moet er uiterst voorzichtig mee worden omgegaan, omdat het soms kan exploderen bij contact met alle andere elementen, met uitzondering van zuurstof, helium, neon en krypton, volgens Chemicool.
- Staalwol barst in vlammen uit bij blootstelling aan fluor, volgens de Royal Society of Chemistry.
- Fluor is ook het meest elektronegatieve element. Fluor trekt elektronen gemakkelijker aan dan elk ander element.
- Gemiddeld is de hoeveelheid fluor in het menselijk lichaam drie milligram.
- Fluor wordt voornamelijk gedolven in China, Mongolië, Rusland, Mexico en Zuid-Afrika, volgens Minerals Education Coalition.
- Fluor wordt gecreëerd in zonachtige sterren tegen het einde van hun levensduur, volgens een artikel uit 2014 gepubliceerd in het Astrophysical Journal Letters. Het element wordt gevormd onder de hogere druk en temperaturen in de ster wanneer deze uitzet om een rode reus te worden. Wanneer de buitenste lagen van de ster worden weggeduwd waardoor een planetaire nevel ontstaat, reist de fluor samen met de andere gassen naar het interstellaire medium en vormt uiteindelijk nieuwe sterren en planeten.
- Volgens het Journal of Chemistry bevat ongeveer 25 procent van de geneesmiddelen en medicatie, waaronder die voor kanker, het centrale zenuwstelsel en het cardiovasculaire systeem, een vorm van fluor.
Huidig onderzoek
Hoewel fluor giftig kan zijn wanneer de concentratie in het lichaam te hoog is, kan het ook een gunstig element zijn om in kankermedicijnen op te nemen, volgens een artikel uit 2018 gepubliceerd in het Journal of Fluorine Chemistry. Volgens het onderzoek laat het vervangen van koolstof-waterstof of koolstof-zuurstof bindingen door een koolstof-fluorine binding in de actieve componenten van het geneesmiddel meestal een verbetering van de effectiviteit van de geneesmiddelen zien, waaronder een hogere metabole stabiliteit, verhoogde binding aan doelmoleculen, en verbeterde membraanpermeabiliteit. Gehoopt wordt dat met de verhoogde effectiviteit van de geneesmiddelen, in combinatie met tumorspecifieke doelgeneesmiddelen of gerichte medicijnafgiftesystemen, de levenskwaliteit van kankerpatiënten sterk kan worden verbeterd ten opzichte van traditionele methoden zoals chemotherapie, waarbij zowel kankercellen als gezonde cellen het doelwit van de geneesmiddelen zijn.
Deze nieuwe generatie kankerbestrijdende geneesmiddelen, evenals fluorprobes om de geneesmiddelen af te geven, is getest tegen kankerstamcellen en heeft veelbelovend aangetoond in het richten en bestrijden van de kankerstamcellen, aldus de studie. De onderzoekers ontdekten dat de geneesmiddelen die fluor bevatten verscheidene malen actiever waren tegen verschillende kankerstamcellen en een betere stabiliteit vertoonden dan traditionele kankerbestrijdende geneesmiddelen.