Facts About Fluorine
周期表で最も反応性の高い元素であるフッ素には、その発見を求める激しい歴史があります。
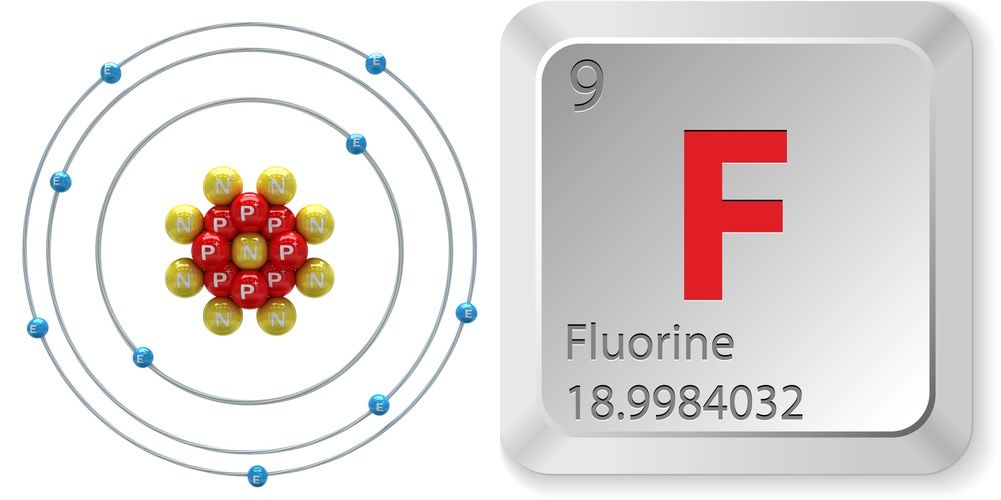
- 原子番号 (原子核内の陽子の数): 9
- 原子記号 (元素の周期表): 1
- 原子番号 (原子核内の陽子の数): 1
- 原子記号 (元素の周期表の): 1
- 原子番号 (原子核内の陽子の数): 2
- 原子記号 (元素の周期表: 1): 2
h2 F
History
初期の化学者は、さまざまなフッ化物から元素を分離することを何年にもわたって試みました。 1986年にドイツの化学者カール・O・クリスティがフッ素の合成に成功し、その結果をInorganic Chemistry誌に報告するまで、それはなかった。 しかし2012年、研究者は放射性蛍石の一種であるアントゾナイトの中に少量のフッ素が閉じ込められているのを発見した。
何世紀にもわたって、蛍石という鉱物は金属の精錬に使われてきました。 今日、フッ化カルシウム(CaF2)として知られているそれは、Chemicoolによると、鉱石中の不要な鉱物から純粋な金属を分離するためのフラックスとして使用されていました。 この「フッ素」は、ラテン語で「流れる」を意味する「fluere」に由来しており、蛍石によって金属が流れるようになったからだ。 ジェファーソン研究所によれば、この鉱物はボヘミアン・エメラルドとも呼ばれ、ガラスのエッチングに使用されていました。
数十年にわたって多くの科学者が蛍石の実験を試み、その組成だけでなく、特性もよりよく知ろうとしてきました。
何十年にもわたって多くの科学者が、蛍石の組成や特性を知るために、蛍石を使った実験を試みました。 ケミクールによれば、この酸は皮膚に少しかかっただけでも致命的なダメージを与えるという。
19世紀初頭、フランスの科学者 Andre-Marie Ampere とイギリスの Humphry Davy は、酸の中に新しい元素が存在する可能性について連絡を取り合っていました。
フランスの化学者アンリ・モワッサンは、何度も毒殺された後、1886年についにフッ素を単離しました。
彼は、乾燥したフッ化水素カリウム (KHF2) と乾燥したフッ化水素酸の電気分解によってフッ素を単離したことで、1906年にノーベル賞を授与されました。
英国王立協会によれば、フッ素は原子力産業において重要な元素です。
英国王立協会によれば、フッ素は原子力産業において不可欠な元素であり、ウランの同位体を分離するのに必要な六フッ化ウランを作るために使用されます。
クロロフルオロカーボン(CFC)は、かつてエアゾール、冷蔵庫、エアコン、発泡食品包装、消火器などに使用されていました。 国立衛生研究所によると、これらの用途は、オゾン層破壊の一因となるため、1996年から禁止されています。 2009年以前は、喘息を抑えるための吸入器にもフロンが使用されていましたが、2013年にそれらの吸入器は段階的に廃止されました。
フッ素は、溶剤やテフロン(ポリテトラフルオロエテン、PTFE)などの高温用プラスチックを含む多くのフッ素化学製品に使用されています。 テフロンは、こびりつきにくさで知られ、フライパンに使われている。
ジェファーソン研究所によると、フッ素は、虫歯予防のために、都市の水道水に約100万分の1の割合で添加されています。
フッ素の健康と環境への影響
すべての人間と動物は微量のフッ素にさらされ、それを必要としていますが、十分な量のフッ素は非常に有毒で危険な元素なのです。 Lenntech によると、フッ素は水、空気、および植物と動物由来の両方の食品に自然に少量含まれています。 より大量のフッ素は、お茶や貝類などの一部の食品に含まれている。
少量のフッ素は骨や歯の強度を保つのに不可欠ですが、摂り過ぎると逆に骨粗しょう症や虫歯の原因となり、腎臓や神経、筋肉に害を及ぼす可能性があります。
気体のフッ素は非常に危険です。Lenntechによると、少量のフッ素ガスは目や鼻を刺激し、多量の場合は致命的になります。
環境では、地殻で 13 番目に豊富な元素であるフッ素は、通常、土壌内に沈殿し、土、岩、石炭、粘土と容易に結合すると、Lenntech は述べています。 植物は土壌からフッ素を吸収する可能性がありますが、高濃度になるとダメージを受ける可能性があります。 例えば、トウモロコシやアプリコットは、高濃度のフッ素にさらされた場合、最もダメージを受けやすく、成長が低下しやすい植物の一つです。
- フッ素は最も化学的に反応しやすい元素なので、Chemicool によれば、酸素、ヘリウム、ネオン、クリプトンを除く他のすべての元素と接触すると爆発することがあり、取り扱いに細心の注意が必要です。
- Royal Society of Chemistry によれば、スチールウールはフッ素にさらされると燃え広がるとのことです。
- フッ素は、他のどの元素よりも容易に電子を引き寄せます。
- 平均して、人体内のフッ素の量は3ミリグラムです。
- Minerals Education Coalitionによれば、フッ素は主に中国、モンゴル、ロシア、メキシコ、南アフリカで採掘されています。
- Astrophysical Journal Lettersで発表された2014年の論文では、フッ素は太陽状の星でその寿命が終わりに向かって作られると述べられています。 この元素は、星が赤色巨星になるために膨張する際に、星内のより高い圧力と温度の下で形成されます。 星の外層が押し流されて惑星状星雲ができると、フッ素は他のガスと一緒に星間物質に移動し、最終的に新しい星や惑星を形成します。
- Journal of Chemistryによると、がん、中枢神経系、循環器系を含む医薬品や薬剤の約25パーセントに、何らかの形でフッ素が含まれているそうです。
現在の研究
フッ素は体内の濃度が高すぎると毒性を発揮しますが、Journal of Fluorine Chemistryに掲載された2018年の論文によると、抗がん剤に含めると有益な元素にもなり得るとされています。 研究によると、通常、薬の有効成分の炭素-水素結合や炭素-酸素結合を炭素-フッ素結合に置き換えると、代謝安定性の向上、標的分子との結合の増加、膜透過性の向上など、薬の効果の向上が見られるという。 腫瘍特異的標的薬や標的薬物送達システムとの併用により、薬物の効果が高まることで、健康な細胞だけでなくがん細胞も薬物の標的となる化学療法などの従来の方法よりも、がん患者の生活の質が大幅に向上することが期待されています。
この新世代のがん治療薬、および薬物を送達するフッ素プローブは、がん幹細胞に対して試験され、がん幹細胞の標的となることで戦うことが期待できるとされています。 研究者らは、フッ素を含む薬剤が、従来の抗がん剤よりも、さまざまながん幹細胞に対して数倍活性が高く、より優れた安定性を示すことを発見しました。